【ディベート:「小線源治療は必要か ?」を司会して】
東北大学医学部附属病院 放射線治療科
高 井 良 尋
今回の放射線腫瘍学研究会のメインテーマとして,当番世話人の有本先生の発案で初めてのディベートが行われた。本来,有本先生が司会すべきイベントであったわけだが,ディベーターを務められると言うことで,小生が司会をすることになった。ディベートは本来,議論の技術を磨くための手段であるわけで,選んだ命題の真偽は本来問題としない。人文科学的なテーマであればやりやすいのであろうが,自然科学がテーマの場合は注意が必要である。すでに,証明されている事柄や高いレベルのエビデンスのあるテーマではディベートにはならない。本来,自然科学的事項はディベートすべきものではなく,科学的手段を用いて証明するものであるはずだからである。今回のテーマでも,決着をつけるなら,randomized
clinical trial (RCT)を行い証明しなければいけないわけであるが,腔内照射が不必要であると真剣に考えている研究者は極めて少ないと思われるし,腔内照射非併用で同等であろうというエビデンスは極めて少ないことからもRCTは倫理的に行えないであろう。しかしながら,だからこそこのようなテーマでのディベートはディベートとしては面白かった。ディベーターのみならず,聴衆にも腔内照射の本質を考えさせるには良い機会ではなかったかと思う。ディベートそのものは,さすが百戦錬磨の有本先生側に軍配が上がったように思えた。
『必要だという立場で』
東北大学 放射線治療科
小 川 芳 弘
小線源治療の歴史
放射線治療における小線源治療の歴史は1900年代から始まっている。1903年にCleavesらが子宮頸癌に対するラジウム腔内照射を試行,その後1930年代にはラジウム治療の基礎がほぼ完成し,その後しばらくラジウムによる低線量率小線源治療が続く。1950~60年代にはアフターローディング法の開発や,Co線源の登場で,RALSが開発され,高線量率小線源治療も始まった。1984年にはICRU勧告によりラジウムは姿を消していくことになる。現在では,セシウム,イリジウム,ヨード,ゴールド等が使用されている。
小線源治療の利点
小線源治療には,①局所に大線量を照射することが可能,②腫瘍内部に線源をおくことが可能であり,腫瘍の動きに線源も追従する究極の動態追跡照射である,③低線量率照射はRBEの高い治療である,等の利点があり,舌癌や子宮頸癌,その他に非常にすぐれた治療効果があることは,すでに明確な事実である。子宮頸癌を例に小線源治療の有用性を検討した。Fig.1に我々の施設における子宮頸癌のRALSの有無別の生存率曲線を示す。RALS無しの症例は少ないが,RALS無しの症例では,生存率が低くなっていた。Table
1に子宮頸癌の外部照射による治療成績を示す。Kageiらの報告はprotonによる治療成績であり,良好な成績であるが,それ以外では,外部照射単独ではやはり良い成績はあげられていないのが現状である。また,本年(平成16年)4月には厚生労働省の手島班の報告として,子宮頸癌の放射線治療で腔内照射を行ったか,行わなかったかで,5年生存率に3倍の開きがあることも示されている。
小線源治療の問題点
小線源治療は放射性同位元素を刺入,挿入するために医療従事者の被爆の問題がある。RALSの開発により,高線量率照射の場合は医療従事者の被爆は無くなったが,低線量率照射の場合は照射時間も長いため,医療従事者の被爆は避けられないものになっている。また,線源の紛失や,脱落など,事故の問題もある。さらに,腫瘍にきちんと照射するためには十分に検討された線源配置が必要であり,そのとおりに配置するためには,やはり専門の技術が必要である。したがって,小線源治療は誰もが簡単にできるものではなく,芸術といわれる所以でもある。またコスト面では,ある程度の症例が集まらないと,装置を導入しても赤字になってしまうという欠点もある。Table
2に小線源治療の現在の保険診療報酬を示す。我々の施設では年間約40例のイリジウムRALS施行症例があるが,この症例数でも,年間で保険診療報酬は約640万円にしかならず,装置購入費,人件費等は全くまかなえるものではない。
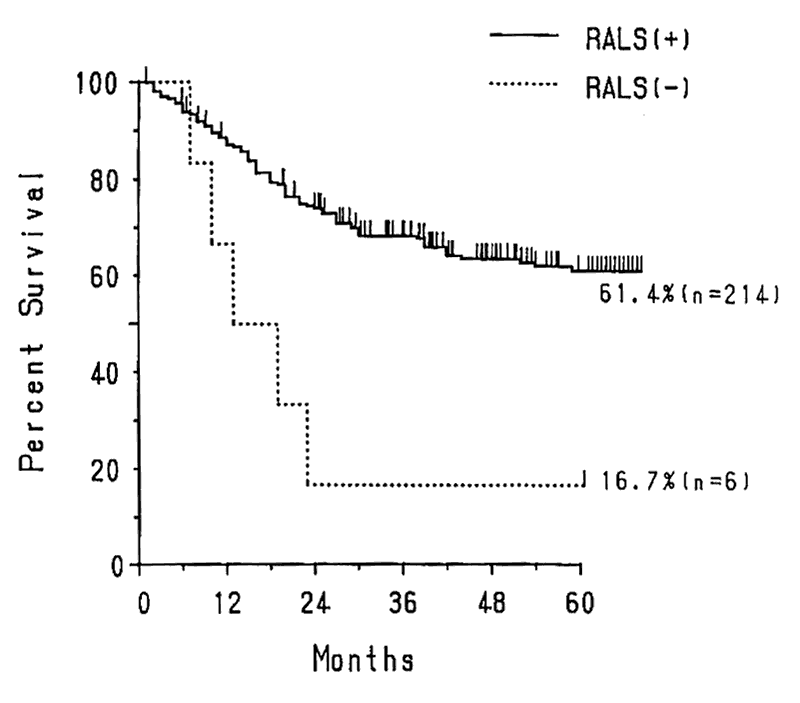 |
Fig. 1 RALS有無による治療成績の差(子宮頸癌)
(1981~1990 東北大・放射線科 RALS+214例 RALS-6例)
|
小線源治療がなくなったら
小線源治療には,上記の如く利点も多いが,欠点も無いわけではない。それでは,小線源治療がなくなったらどうなるだろうか。すなわち,小線源治療に替わる治療法があるかどうか,ということになる。舌癌や子宮頸癌での治療成績の良さは病巣部に高線量を与えることができるから,という事がひとつの理由になっている。子宮頸癌では,腔内照射に代わる照射法としては,定位照射や,粒子線治療があげられるであろう。舌癌の組織内照射に代わる照射法としては,電子線照射や,定位照射等があげられるであろう。いずれもその治療法で治癒する可能性はあるが,現時点での報告では成績は小線源治療に劣る。小線源治療無しで同等の成績が出せるかどうかを明らかにするためには,大規模なトライアルが必要である。しかし,パイロットスタディで同等かそれ以上の成績があげられなければ,ランダムトライアルに移行するのは難しい。
これからの小線源治療
近年の日本人のライフスタイルの変化により,わが国では子宮頸癌は減少傾向にあり,肺癌,結腸癌,乳癌,前立腺癌,胆道癌等が増加してきている。したがって,小線源治療の対象も子宮頸癌の腔内照射から,各管腔臓器の腔内照射や,乳癌や前立腺癌の組織内照射への転換も必要になってくると考えられる。また,治療計画技術の進歩により,線源読み取りの自動化や,PET/CT
(MRI)等,機能画像による標的の詳細決定,線量分布の最適化などが可能になってくるであろう。小線源治療は芸術,職人芸と言われてきたが,小線源治療の発展のためには,職人芸にこだわらず,芸術から科学への脱皮が必要である。
結 語
小線源治療は医療従事者の被爆や,患者への侵襲も無視はできないが,現時点での治療成績を考えると,その治療成績に匹敵する,小線源治療に代わりうる照射法がないかぎり,小線源治療は必要であると言わざるをえない。
『組織内照射の場合』
新潟大学大学院医歯学総合研究科遺伝子制御講座 放射線腫瘍学分野
土 田 恵美子
(1) 背 景
組織内照射は,腫瘍の大きさや刺入可能部位かどうかなどを検討した結果,腫瘍全体が小線源で取り囲みうる状況の場合はよい適応となる。病変部へ高線量を集中させることができるので,高い局所制御が期待できる。単独では腫瘍全体に対し十分に線源を配置できない場合には,外照射と併用することで根治治療を目指すことができる。外照射後の残存腫瘍に対し,組織内照射で局所制御を得ることも可能である。137Csや 198Auが舌癌,口腔底癌などの頭頚部癌や膣癌,外陰癌などに実用線源として用いられてきた。最近は 192Irの針金状線源による後充填法が普及し,肺癌や軟部組織腫瘍など適応が拡大された。また,遮蔽が容易な永久刺入線源として 125Iの使用が認可された。
(2) 組織内照射に必要な条件
適切な線源の選択と物理学的線量計算法,生物学的線量評価法が確立される必要がある。医療者に対しては,適切な線源配置を得るために最適な線量分布に対する理解と外科的手技の習熟,組織耐容性についての知見と十分な経験が要求される。
(3) 組織内照射の利点
病変部への線量集中性の他に,組織内照射の利点として以下に列挙する事項が挙げられる。
1. 画像所見のみでなく,視触診で病変の広がりを評価・確認しながら治療を行うことができる。
2. スペーサーを置く等の工夫により,周囲正常組織の線量をさらに低減できる。
3. 低線量率照射はoxygen enhancement ratioが高線量率照射に比べて低い,照射中に低酸素腫瘍細胞の再酸素化が有効におこるなど低酸素細胞の制御に有利と考えられる。低線量率組織内照射では照射による増殖細胞の細胞周期の同調が治療中に有効におこっている可能性がある。これらの特徴の他,空間的線量分布の点で,線源から距離の2乗で線量分布が急峻に低下するとともに,線量率の低下も加わるので生物効果の勾配は線量分布と線量率効果の相乗になる。
4. 多発癌の場合でも有効に治療を施行できる。
5. 通常の外照射に比し,短期間の入院治療で済む。
6. 医療コストの面で多くの患者に寄与する。(健康保険が有効で,H16年度の放射線治療管理料は3,400点,密封小線源治療料として 192Ir高線量率の場合は7,500点(+線源代金加算14,285点),その他の線源の場合は6,000点の請求となる。)
(4) 組織内照射の欠点
患者の側から見た組織内照射の欠点として,低線量率組織内照射ではRI病室への入室が必要であること,適応範囲が限定されること,高線量が照射されることが多いので晩期有害事象が生じた場合は重症になりやすいことが挙げられる。医療者側から見た欠点として,高線量率を用いた遠隔操作式後充填法を除けば医療者の被曝があること,技術の習得が容易ではないこと,線源の減衰があること,放射線防護法と医療法のもとで厳重な管理を行う必要があることが挙げられる。
(5) 今後の組織内照射の展望
最大の欠点である医療者の被曝を避けるために高線量率 192Ir線源を用いた後充填法が普及すると予測される。このことは患者のRI病室への入室を不要とするので適応が拡大し,短時間照射で多くの患者を治療できる。また低線量率照射に比し,線量分布の最適化における利便性,再現性,正確さが得られる。一方で適応拡大のための手技の開発と外科的技術が要求されるので,外科医との共同作業として経験を重ねることになるであろう。技術の習得,経験の蓄積が必要なことに加え,治療機器の購入時のみならず 192Ir線源(半減期74日)の交換に費用がかかるので,症例を集中させる必要があると考える。医療コストの面からは,他の放射線治療と比較して適正な診療点数がつけられることを期待する。
(6) ま と め
解決すべき問題点はあるが,確実な手技をもって治療すれば,腫瘍が限局した大きさの場合,小線源治療は非常に優れた方法であり,小線源治療は必要である。
『不要だという立場で』
石巻市立病院
松 下 晴 雄
はじめに
小線源治療は必要ではないというよりは,「無しで済ませるべきではないか。」と考える。
ただし,数年後など将来に向けての議論ということを確認しておきたい。
「現在あるRALSの施設を更新すべきか ? 新たに組織内照射の手技を習得すべきか ? これらを行わずに済ませられないものか ?」ということを考えると現時点では小線源治療に対するnegativeな要素が多いということである。
現在行われている(密封)小線源治療
①
|
一時装着治療用線源を用いた近接照射,組織内照射
(60Co, 192Ir, 127Csセシウム,Raラジウム;Raは使用停止勧告で急速に減少しつつある。)
|
②
|
RALSでの腔内照射,組織内照射
(60Co, 192Ir;旧式の装置には使用停止勧告が出ている。)
|
③
|
永久刺入による組織内照射
(198Au, 125I, 103Pdパラジウムなど)
|
①
|
舌癌など口腔癌に対する組織内照射,近接照射(治療実績あり。)
|
②
|
食道癌に対する腔内照射
|
③
|
気管支癌に対する腔内照射
|
④
|
胆管癌に対する腔内照射
|
⑤
|
子宮頸癌(体癌)に対する腔内照射,組織内照射(実績,標準治療としてのコンセンサスあり。)
|
⑥
|
直腸癌など下部消化管に対する腔内照射
|
⑦
|
前立腺癌に対する永久刺入や高線量率RALS
(治療効果は手術や外照射と同等であり,選択肢としてコンセンサスを得る可能性あり。)
|
⑧
|
その他直腸腫瘍床,乳房,子宮頸部,皮膚病変などに対する組織内や近接照射
|
北海道,東北で小線源治療(RALS)が可能な施設;月刊新医療 2003年12月号より
〈北海道〉
|
| |
北海道大学病院(マイクロセレクトロンHDR)
北海道がんセンター(旧国立札幌病院)(マイクロセレクトロンHDR)
札幌厚生病院(マイクロセレクトロンHDR)
旭川厚生病院(バリソース)
旭川市立病院(マルチソース)
札幌医科大病院(ラルストロン20B)
市立釧路病院(ラルストロン20B)
市立函館病院(ラルストロン20B)
|
〈青森県〉
|
| |
弘前大学(ラルストロン20B, IBUシステム)
青森県立中央病院(ブフラー facts)
青森市民病院(ラルストロン20B)
青森厚生病院(ラルストロン20B)
|
〈秋田県〉
|
| |
秋田大学病院(バリソース)
|
〈岩手県〉
|
| |
岩手医科大学病院 (マイクロセレクトロンラルストロン20B)
岩手県立中央病院(ラルストロン20B)
県立北上病院(ラルストロン20A)
盛岡赤十字病院(ラルストロン20B)
|
〈宮城県〉
|
| |
東北大学病院(IBUシステム)
国立仙台病院(マイクロセレクトロンHDR)
宮城県立がんセンター (ラルストロン20B)
|
〈山形県〉
|
| |
山形大学病院(ブフラー facts)
山形県立中央病院(マイクロセレクトロンHDR)
山形県立日本海病院 (ブフラー facts)
|
〈福島県〉
|
| |
福島医科大学病院(ラルストロン20B)
総合南東北病院(ブフラー facts)
(下線は使用停止勧告装置)
|
RALS以外の密封小線源治療を施行している施設;各施設のホームページを検索して
北海道がんセンター(旧国立札幌病院)
札幌医科大学付属病院
H13年実績では組織内照射14例14件,(腔内照射45例107件)
弘前大学付属病院
青森県立中央病院
参考〈東北地方以外〉
東京医科歯科大学付属病院
平成15年で約100例の舌癌が行われている。(子宮などの腔内照射は30例)
広島大付属病院
年間約20例の低線量率組織内照射を施行。
小線源治療の実際(宮城県の場合)
1) 組織内照射
密封小線源では行われていない。
2) 腔内照射
(子宮頸癌,子宮体癌,胆管癌,気管支癌)
宮城県内施設での症例数
①
|
東北大学病院;Ir-RALS
子宮頸癌25例,子宮体癌1例,断端再発例9例,胆道癌6例 計41例
|
②
|
仙台医療センター(旧国立仙台病院);Ir-RALS
子宮癌6例,気管支癌1例 計7例
|
③
|
宮城がんセンター;Co-RALS
子宮癌 18例 計18例
|
治療方法の選択要因優先度;一般論
1. 治療成績
2. 患者さんへの負担
(身体的侵襲,時間的,経済的負担)
3. 医療現場への負担
(時間,煩雑度等)
4. 経済性
(病院収益への貢献,医療費の抑制)
小線源治療の問題点;一般論
①
|
病変への線量集中が長所ではあるが,1回線量を大きくせざるを得ないことが多く,その場合隣接臓器に晩期障害の危険がある。
|
②
|
患者さんへの身体的,精神的負担が少なくない。
(何と比べるかによって当然違うが…)
|
③
|
治療の実施に医療スタッフのマンパワーが必要。
(少なくとも常勤治療医が必要)
|
④
|
設備投資が必要であるが,採算を取ることが困難。
|
各疾患ごとの問題点
|
|
(子宮癌)
現在の外照射+腔内照射は今後も標準治療であり続けるのか ?
|
腔内照射が必要な理由としては時間的,空間的な照射野の適正さ,線量の集中性,が考えられるが,CTを用いての3次元照射計画法やimage-guided
radiotherapyが各施設で実用できれば,肉薄,凌駕できるのではないか。 |
| |
① 晩期障害 ; |
子宮癌根治照射(化学療法同時併用)の晩期障害としては直腸粘膜障害,膀胱粘膜障害,瘻孔形成など,Grade
3以上の晩期障害が5年で10%前後出現するとされる。晩期障害の出現は経年で頭打ちとはならず,観察期間が長くなるにつれ累積例数は増加する。 |
子宮頸癌の罹患数は減少傾向であるが,近年若年者の比率が増加している。よって治療後の観察期間は長くなり,晩期障害の発生に関してより慎重さが求められると考えられる。 |
| |
② 経済性;下記のごとく,高額な治療機器(RALS)購入が採算に合わない。
例) III期頸癌症例を治療した際の保険点数(専任加算なしで) |
a) Ir-RALS併用
4門(Box) 30 Gy/15 fr+前後2門(中央遮蔽)20 Gy/10 fr+RALS 6 Gy 4回+治療管理料+線源加算 |
合計62,786点 |
b) Co-RALS併用
4門(Box)30 Gy/15 fr+前後2門(中央遮蔽)20 Gy/10 fr+RALS 6 Gy 4回+治療管理料 |
合計44,000点 |
c) 体外照射のみ
複雑な照射法で60 Gy/30 frの照射を行った場合+治療管理料 |
合計51,130点 |
| 例) RALSによる病院の収支 |
〈東北大学(2003年)の場合〉
|
| |
収入;子宮癌35例各4回RALS施行として週1日,平均2.8件で35例*4回*3,000点=420,000点,+管理料35例*3,100=108,500
点+線源加算35例*14,286=500,010点
年間総計 10,285,100円
支出;線源代金3,000,000円+保守点検費用約5,000,000円+人件費+電気代など
人件費,電気代などを除いても差し引き僅か228万円程度の利益でしかない。これでは設備購入費用はとても捻出できない。
|
〈宮城がんセンター(2003年)の場合〉
|
| |
収入;18例*4回*1,500 点=108,000点+管理料18例*3,100=55,800点
年間総計約163.8万円 (月間約6回で13.6万円)
採算に合わないのは明らか。
|
〈仙台医療センター(2003年)の場合〉(子宮癌のみで)
|
| |
6例*4回*3,000点=72,000点,+管理料6例*3,100=18,600点,+線源加算6例*14,286点=85,716点
年間総計約176万円
線源代,保守費用もまかなえず,使用できるように準備しておくと赤字が増えていく状況。
|
③ 患者さんへの負担;治療の際の精神的,身体的苦痛のほかに,腔内照射可能施設の少なさからくる通院の負担も増加していく。RALS可能な施設が減少すると,さらに負担が増加。
④ Bulky tumor など腔内照射では線量分布が不良である症例があるのではないか ?
⑤ 機械的にcenter split とした照射野が標準でよいのか ?
⑥ 厚生労働省統計資料から子宮頸癌の罹患率の低下と若年層の明らかな増加があることがわかる。
RALSの適応症例の減少が予測される。また20歳台などの若年者に晩期障害の出現が少なくない現在の標準的放射線治療を進めて問題がないのか
?
|

|
(舌,口腔癌)
1) 組織内照射を行っている施設が少なすぎる。(遠隔地まで受診する負担となる。)
2) 治療成績が施行者の手技に依存する。
3) 体外照射のみよりは治療実施時の侵襲,医療者への負担が大きい。
4) 再生医療の進歩で外科的治療の適応が広くなる可能性が考えられる。
(前立腺癌)
外照射のほうが適応が広く,治療成績にも差がない。
→治療成績が同等であれば侵襲の少ない治療法を選ぶ人が多いのではないか ?
高齢者が多く,治療期間が長いことに支障をきたすことは少ない。
急性期有害事象や合併症が多い。
採算性は不透明(永久刺入の保険点数未定) |
小線源治療なしで対応するには
子宮癌に対する外照射での治療
*CF-IMRT (cutting field-IMRT);固定多門+原体照射などforward planningで照射。各疾患ごとにテンプレートを作成して計画を簡便化する方法もあるが,日常診療では煩雑か
?
子宮頸部に60 Gy,傍子宮組織に55 Gy,内腸骨領域に40~50 Gyと設定した報告あり。病変部は2.4 Gy/fr程度か ?
舌癌,口腔癌に対する外照射での治療
適切にスペーサーを使用し,多門照射,IMRTなどで加療か ?
追加 〈組織内照射の生き残る道〉
①
|
組織内照射のできる施設をセンター化し,症例集中する。(県で1ケ所程度か ?)同センターでは高い技術力を発揮して良好な成績を残す。
|
②
|
その施設での治療を望んだ患者さんは必ずすぐ受け入れられるような,ベッド数,スタッフ数,施設の規模を準備する。
|
③
|
day surgeryのような形,あるいは遠方からの患者さんには1~2泊での腔内照射や組織内照射をいつでも行えるような体制とする。
|
④
|
専用個室料の収入や平均在院期間日数の短縮で病院経営にも貢献する。
|
コメンテーター:独立行政法人国立病院機構北海道がんセンター 放射線科
西 尾 正 道
「小線源治療は必要か ?」というユニークなディベートが開催された。外部照射技術の進歩により,こうした疑問を持つ医師が増加したのであろうか。しかし,放射線治療において小線源治療の必要性を否定することは,癌治療において放射線治療そのものも必要性がなくなることに通じるものであることを自覚しているのであろうか。日本の現状は小線源治療を行える施設は約100施設であるが,質の高い治療内容で小線源治療を行っているのは筆者の判断では10施設以下である。こうした現状から,小線源治療の経験も乏しく,また良く使いこなしていない放射線治療医が多いことは大変残念なことである。
確かに小線源治療の適応症例は減少し,当科でも20年前は全治療症例の10% 以上が小線源治療を受けていたが,現在は5% 以下となっている。しかし小線源治療の適応となる症例の治療では,安価な医療費と短期間の入院で治療を終え,高いQOLで治癒を得ている。小線源治療は種々の形状の線源を使い分ける事により,より有効性を発揮し,線量分布に優れた治療法である。
病院経営上は薦められる治療法ではないが,患者側からすれば,こんなに良い治療法も少ない。我々医師はとかく病院経営上の視点から考え勝ちであるが,治療の優越性は患者側に立って考えるのが本来であろう。外部照射では呼吸同期や金球の埋め込みなどによって時間的因子をも考慮した4次元照射が工夫されている。しかし小線源治療は実は治療上の工夫によっては5次元照射の治療法である。例えば舌癌の組織内照射においては,刺入した線源は舌の動きに伴い動き,さらに硬く放射線抵抗性の腫瘍部分には線源を密に刺入し,厚みの無い比較的治癒しやすい腫瘍部分には最低線量を投与することもできるため,腫瘍の生物学的な特性をも考慮して線量分布を調節できるという意味で5次元照射の世界なのである。またRALSが普及しているが,低線量率照射の持つ生物学的長所は魅力的であり,特に再発例の治療では再照射でも障害なく治癒する症例も多く経験している。治癒率の高い癌種は「見える癌・触れる癌」である。その点では腫瘍を直接見て触って線源を配置できる多くの小線源治療は放射線治療医にとって,腫瘍と正常組織の反応を直接観察できることから,良い訓練の場であり,バーチャルな外部照射の世界での治療に多くの示唆を与えてくれるものである。重粒子線治療で全ての患者の治療を行なえる訳ではない。外部照射という片翼飛行ではなく,小線源治療も駆使した両翼飛行で放射線治療を行う姿勢が望まれる。現実的には施設内での制約の中で,得意な方法で治療すればよいのであろうが,小線源治療の適応を熟知し施設間の紹介も考えるべきである。
医療は医学的事実を基にした応用科学であり技術も介在する。その意味では,「下手な手術より上手な放射線治療であり,下手な放射線治療より上手な手術」である。同様に「下手な外部照射より上手な小線源治療,下手な小線源治療より上手な外部照射」である。
最後に当科で小線源治療を行った代表的な数症例(本稿では写真省略)を提示するが,こうした見事に治癒した状態以上に外部照射できれいに治癒できると自信のある方は挙手して頂きたい。
『適応からみた小線源治療』
コメンテーター:青森県立中央病院 腫瘍放射線科
眞里谷 靖
1. 小線源治療の適応範囲
“小線源治療が必要か”を論じる前に,小線源治療は適応範囲が限られた治療であることに今一度言及しておきたい。詳細は成書に譲るが,適応となる対象は,舌癌を中心とする頭頸部腫瘍,子宮癌,膣癌,気管・気管支癌,食道癌,胆道癌,直腸癌などが主であり,泌尿器科あるいは外科などの協力を得てアプリケータ留置を行うことにより,前立腺癌,乳癌,脳腫瘍などにも適応が拡大される。いずれにせよ,体表(術野内に露出された臓器表面を含め)ないしは管腔臓器等を経由するアプローチが技術的に必要であり,これが適応の限界をもたらす要因となる。
一方,外照射にはこの様な制約が殆どない。勿論critical organへの照射線量を耐容線量内に抑える必要はあるが,小線源治療でも同様の課題はあり,さらに近年の外照射の技術的進歩(回転原体照射,3-D原体照射,STI,IMRT,陽子線・重粒子線治療など)は,外照射にも高度の空間的線量集中性と線量分布の改善による治療可能比の向上をもたらした。従って,今回のテーマを論ずるにあたっては,外照射が持つ適応に関する“汎用性”という圧倒的な長所と急速な技術的進歩を十分に認識した上で,小線源治療と外照射の“対決”よりは“住み分け”のあり方を論議しても良かったのだろう。
しかし実際のディベートでは,小線源治療の適応範囲内で外照射が治療効果において同等ないし勝る可能性はあるか否か。あるいは小線源治療に置き換わる可能性があるか否かが,主要な争点となっていた(?)。この結果,"小線源不要派”には圧倒的に不利なディスカッションが展開された。ディベート終了後の現時点で考えると,上述の適応や技術に関する問題のほか,非通常分割照射や併用放射線化学療法による外照射の治療成績向上,高LET粒子線治療の放射線生物学的メリット,再建手術の進歩に伴う集学的治療の変容,分子標的治療など新たに登場したmodalityとの併用効果など多様な観点から,土俵をもっと大きく捉え,all
or nothingではない形で“小線源不要(というよりは外照射重視)派”を支持することも出来たのではないか,と“中立派”コメンテーターとしては少々後悔している。組織内照射が得意とする分野では,外照射は当然分が悪い。“不要派”が始めから受身に回り,自ら土俵を小さくした印象が強かった(?)ことが惜しまれる。
2. 適応部位における小線源治療
小線源治療は,放射線治療の分野で最も成功した治療法のひとつであるとされる。特に,舌癌に対するLDR組織内照射と子宮頸癌に対する腔内照射は,間違いなく手術に匹敵するgold
standardの治療法である。成功の理由としては,今回“小線源必要派”の先生方も指摘されていた,良好な線量集中性と標的追随性,LDRでの線量率効果などにより治療可能比が高いことが,まず挙げられる。また,全般に治療期間が短く患者側の経済性に優れることも重要である(治療期間が短いことはrepopulationの観点からも長所といえるが,ディベートでは指摘されなかった)。これらの詳細に関しては,放射線生物学や小線源治療の成書を参考にされたい。
しかし,この“成功”の裏には勿論問題もある。例えば,旧来のLDRでは術者の被曝を免れないことや,治療成績が術者の技量・習熟度などに大きく依存することなどは周知の事実である。また,線量推定誤差は外照射の比ではなく,実際の舌癌LDR組織内照射において,刺入後2~3日経ったのち浮き上がってきた線源を回診時に押し込んだ記憶を持つのは,私だけではないと思われる。一方,コスト・ベネフィットの面からみると,イリジウム線源は半減期が短いために,LDR,HDR共に必ずしもpayできるツールとは言えない。たまたま適応患者が少ない時期には,徒らに線源交換を行うばかりで照射実績に繋がらないことも稀ではない。今後は,HDRイリジウム・ラルスが小線源治療の主体になると思われるが,一病院レベルでの(地域・社会レベルの話ではない)コスト・ベネフィット比は必ずしも高くないことには留意する必要があるだろう。この辺りは,ディベートにおいて“小線源不要派”がもっと突いて良いポイントだったと思われる。
3. 小線源治療の放射線生物学的メリットと問題点
LDR小線源治療の放射線生物学的メリットは,いわゆる線量率効果で表現される。"小線源必要派”の土田先生がディベートで詳しく述べられていたので詳細は省略するが,この線量率効果によりLDRでは細胞の放射線感受性をdiscriminateすることが可能になる。例えば,腫瘍細胞に比較して正常組織細胞での線量率効果は全般に大きい。この結果,LDR小線源治療では良好な腫瘍制御が得られる一方で,線源近傍に莫大な線量を与えながらも重篤な晩期障害発現を抑えながら治療することが可能となる。
一方,HDR小線源治療では線量率効果のメリットはなく,therapeutic gainの主体は線量分布の良さに依存している。従って,治療可能比はLDRに比較し低くなることが当然予想されるが,実際,Lauらが舌癌組織内照射でHDRイリジウム・ラルスを用いた際に,LDRでの線量(60
Gy/6 days)とLQモデルを用いて等価とみなした線量(45.5 Gy/7 fr/3.5 days)を投与したところ,HDRでは腫瘍制御がLDRに劣ると共に晩期障害の増強が認められることを報告した(Radiother Oncol 39 : 15-18,
1996)。これは,HDRの至適分割・線量を決定する際には安易にLQモデルなどの生物学的モデルを適用出来ないことを示すと共に,組織内照射において線量率効果が占めるウェイトの大きさを示唆している。この問題を克服するためには,fraction
sizeを適当に小さくした多分割照射をHDR小線源治療に用いる必要があり,大阪大学では1回6 Gy,1日2回,総線量60 Gyを6~9日間で投与することによって,腫瘍制御,晩期障害などの面で満足すべき成績を得たと報告している。
以上の話から導かれるのは,適応部位でLDR小線源治療と外照射とを比較した場合には,外照射でどんなにconformityを高めても線量率効果の点で分が悪いこと。しかし,HDR小線源治療が外照射の相手となる場合には(分割に関しては外照射と同じ立場なので)これは必ずしも当てはまらず,特に標的容積が増大すると(小線源治療では晩期障害がより問題となるため)外照射が有利となる場面が増えると推測され,この点で“小線源不要派”にも十分付け入る空はあったと思われることである。
4. Stereotactic irradiation(STI)
冒頭でも述べた如く,小線源治療の適応範囲は限られている。適応範囲外の対象,例えば肺野に孤立性に存在する小さな肺腫瘍で手術適応外のケース,或いは小さな脳転移に対して小線源治療は殆ど無力といえるが,STIは外科的治療にひけをとらない治療効果をもたらす可能性がある。STIが出現する前の外照射では,その効果はある程度頭打ち(例えば“supralethal dose”というconceptがある)の感があったが,いわゆるparallel
organにおけるSTIの臨床的有用性には予想以上のものがあり,やはり適応に制約はあるものの我々に大きなインパクトを与えたことは間違いない。
ただし,STIでは高線量域に含まれる組織は壊死に到る可能性があること(逆にSRSはそれを目的としている。)を,銘記しておくことも必要である。LDRでは,主に線量率効果のおかげでかなり高線量を投与された組織でも壊死を免れる可能性があるが,HDRでは小線源治療,外照射いずれも線量率効果の恩恵にあずかることは出来ない。特に,STIでfraction
sizeが大きくなる場合には十分な注意が必要であり,体幹部などでは動体追跡や固定の工夫でPTVを大きくしないことが肝要となる。
いずれにせよ,STIは,小線源治療の適応範囲外で良好な治療成績を期待できるtoolのひとつであり,従来とは異質の発想を我々に与えた。また,対象によっては,これまで小線源治療が得てきた地位に匹敵するポジションを既に獲得したとも考えられ,今回のディベートではこの事実をもっと強調しても良かったのかもしれない。
5. ま と め
早期舌癌や子宮頸癌に対する小線源治療は,治療手技として現在もなお確固たる地位を保持している。しかし,時代は速やかな変化を遂げつつあり,我々も,治療技術の急激な進歩,医療被曝の問題,年々強まる社会側から医療者側への様々な圧力・制約などを頭に入れた上で,自分達の有する治療手技・知識を常に見直す作業を要求される様になってきた。この様な現代に於いて,小線源治療といういわば伝家の宝刀を批判的な目により改めて吟味することが出来たという点で,今回のディベートは大いに意義があったと“中立派”コメンテーターは考えている。


