 |
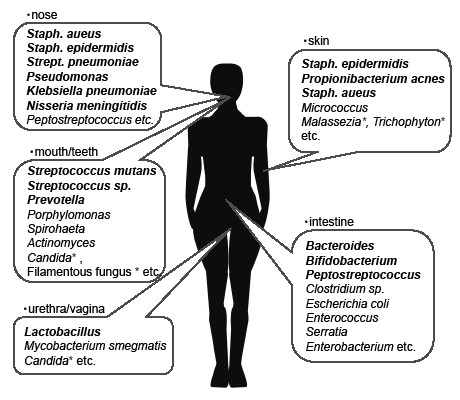
| Fig. 1 Human indigenous microbial flora |
宇宙航空環境医学 Vol. 49, No. 3, 37-51, 2012
総説
目に見えないヒト常在菌叢のネットワークをのぞく
太田 敏子
宇宙航空研究開発機構 宇宙飛行士運用技術部 宇宙医学生物学研究室
A Peep Into Invisible Community of Human Indigenous Microbes
Toshiko Ohta
Japan Aerospace Exploration Agency, Space Biomedical Research Office
ABSTRACT
Humans have had a close-knit relationship with microbes since time immemorial. The human body is inhabited by microbes that are indigenous to it. These indigenous microbes occupy the spaces that contact the outside world:the skin, eyes, nose, mouth, throat, respiratory tract, digestive tract, urinary organs, and vagina. Therefore, if we discuss human homeostasis, we have to give serious thought to the role of the human microbial flora. Because bacteria were first isolated as pathogenic germs and identified by culturing, a “bacteria-free” policy was the trend of the times. However, with the development of the biofilm concept in the 1990s, it has become clear that microbes take dual directly-opposed profiles: protection and attack of the human body. To prevent attack by microbes, we need to know the exact structural profile of indigenous microbes. However, it is difficult to identify and characterize the entire human microbiome because, of all these many species, only a very few can be cultured. Recent molecular gene techniques have been pioneered to permit the identification of microbial flora without their cultivation. This international project team should soon identify and characterize the entire human microbial flora.
In this report, I give general remarks about the characteristics and physiological roles of the human indigenous microbial flora on the basis of research conducted to date. I will describe an interesting microbial cell community (slime city) and cell-to-cell communication system within the biofilm. I will also introduce the specific profiles of major microbes and show how the gut flora, which is still not well understood, has been playing an important role in host immune.
(Received:2 March, 2012 Accepted:22 March, 2013)
Key words:Human indigenous microbes, 16S ribosomal RNA gene analysis, Mobile genes, Mucous membrane immunity, Biofilm, Quorum sensing
はじめに
人体に日常的に共生して棲息する細菌や真菌などを「常在菌叢(indigenous microbial flora)」とよんでいる。その多くは細菌である。人類が地球上に現れたのは400万年前のことであるが,エジプト ドゥーシュ遺跡,中国馬王推郷古墳,インカ遺跡などに残されたミイラには虫歯の跡が見出される。これらからも解るように,太古からヒトと菌との深く長い付き合いがある割には,ヒトの常在菌についてあまり多くのことが知られていない。細菌は数 µm以下の目に見えない小さな細胞だからである。じつは,常在菌は人体が外界と接触している場所のあらゆる部分に生息している。無菌である血液,皮下組織,脳脊髄,腹腔,肺胞を除いて,皮膚,眼,鼻腔・口腔から肛門までの腸管,咽喉から肺までの気道,尿路,女性の性器のどれにも棲んでいる。その菌の数は場所により異なっている。また,細菌の種類により好みの居場所がある37)。しかも,持っている常在菌の種類は人によってまちまちであり,病原性のある菌もない菌も含まれている。しかしながら,常在菌というのは,本来の居場所に定着しているかぎり,またその人が健康で通常の免疫力を保っているかぎり病気を起こさない。では,ヒトと常在菌はどのように均衡を保って共生しているのだろうか。常在菌叢の中をのぞくと驚くべき「菌のネットワーク」を垣間見ることができる。本稿では,その巧妙な社会(ネットワーク)の一端を紹介する。
人の長期宇宙滞在が可能になった今,微小重力,宇宙放射線,閉鎖空間という特異な宇宙環境では,人体は様々な生理的リスクを受けることが明らかになっている。骨密度低下,筋萎縮,体液シフト,免疫低下,生体リズムの脱同調などがその顕著な例である30)。また,狭い空間に人種の異なる6人の飛行士が共通の宇宙食を食べて共に生活する。このような生活環境では,ヒトの生理的変化に伴い,常在菌叢も大きな変化を示すに違いない。本来の菌叢を保っているのかどうか知ることは極めて興味深い。
1. 人体における常在菌叢の分布
ヒトは胎内では無菌の状態にあるが,出産のときに母親の産道で初めて微生物に汚染される。その後環境からの汚染が加わり,生後1日目から微生物叢の定着が始まる。しかし,その分布は,年齢,性,民族性,食事,生活環境などにより異なっている。成人男子の平均的な常在菌フローラをFig. 1に示す。また,Table 1に人体の各部位における主要な常在菌叢とその菌の密度を示す。本表は培養可能な菌種について示したものである。
しかしながら,近年の分子生物学的遺伝子解析を用いた先端技術の進歩により,培養が不可能または,困難な微生物を高感度で検出できるようになった。つまり,ヒトの体の部分の試料中から抽出したDNA断片を鋳型にしてPCR(polymerase chain reaction)28)という反応により細菌だけがもつ特徴的なマーカー遺伝子(16SリボソームRNA遺伝子)を増幅して検出する方法42)である。
16SリボソームRNA遺伝子解析:通常,細胞のリボソームは大小2つの複合体を造って機能している。細菌細胞では,その小さいほうの分子であるリボソームRNAは16Sの大きさであり,真核細胞のリボソームの18Sとは異なっている。したがって,16SリボソームRNA遺伝子は細菌遺伝子のマーカーとなる。しかもこのマーカー遺伝子には,その菌種に特異的な一部の配列が含まれており,菌の種類が特定できるという利点がある。これを細菌リボソームRNA遺伝子の16S解析とよんでいる。さらに現在,この16S解析の応用として,超高速DNAシーケンサーを用いてDNAの塩基配列を全部調べ(メタゲノム解析),その大量の解析配列の中から,細菌だけがもつ特徴的なマーカー遺伝子を目印として,コンピューターで菌種を特定することが可能になった23)。これにより,日本を含む世界ネットワークの国際プロジェクトが進展して現在,人体の常在菌叢などのデータベースが蓄積されている3,13,22)。
| Position | Cell density | ||
| skin | 103-106( /cm2) | ||
| nose/throat | 106-108( /ml) | ||
| mouth(teeth) | 1011 ( /g) | ||
| mouth(saliva) | 105-109( /ml) | ||
| stomach | 0-103 ( /ml) | ||
| intestine | 1012 ( /g) | ||
| urethra/vagina | 104 (/ml) | ||
 |
| Fig. 1 Human indigenous microbial flora |
2. 皮膚常在菌叢
2-1 分布とその特徴
皮膚は,面積にするとタタミ2畳分(3.1×104cm2)に相当するヒト最大の排泄臓器である。その皮膚は直接外界に接しているため,表層には主として好気性菌が,毛包や脂線には嫌気性菌が常在菌として生息している。好気性のブドウ球菌属(Staphylococcus epidermidis, S. aureus)やミクロコッカス属(Micrococcus),嫌気性のアクネ桿菌(Propionibacterium acnes)がもっとも普遍的に見られる(Fig.1,Table1)。また数は少ないが,真菌(カビ)のマラセチア菌(Malassezia),カンジダ菌(Candida),白癬菌(Trichophyton)も生息する。カビは少々いる程度では問題にならない。一般的には「通過菌」が皮膚感染症を起こすが,宿主側の条件次第では「常在菌」も感染症を発症する。
菌の種類や量は個人差があるものの,皮膚にはこれまで培養可能な菌としてブドウ球菌やアクネ桿菌をはじめとする10種余りの菌属(Genus)が100万個(106/cm2)いると考えられてきた37)。しかしながら,近年の米国立ゲノム研究所などの先端技術分析では,皮膚表面には約200種類以上の菌属がいることが明らかになった34)。種(Species)にすると1,000種相当の常在細菌が生息しており,優勢種は体の各部分で違うらしい。また,細菌は膜構造の違いにより色素染色性(グラム染色とよばれる)が異なり,グラム陽性菌とグラム陰性菌の二つに大別される。その性質は人体に常在するのに関係しない。
2-2 pH を弱酸性に保ち,バイオフィルムを造る
表皮ブドウ球菌
皮膚表層に常在するブドウ球菌属には(Fig.2),表皮ブドウ球菌(Staphylococcus epiderimidis)と黄色ブドウ球菌(Staphylococcus aueus)があり,好気性のグラム陽性菌で前者が優勢である。同じブドウ球菌でも黄色ブドウ球菌は,コアグラーゼとよばれる血液の成分である血漿を凝集する酵素やマンニット分解能をもつが,表皮ブドウ球菌はこれらをもたない。そこで,表皮ブドウ球菌はコアグラーゼ陰性ブドウ球菌(coagulase-negative Staphylococcus:CNS)ともよばれて病原性も低い。表皮ブドウ球菌は,皮脂や汗をエサとして食べ「弱酸性の脂肪酸」を産生する37)。このように,皮膚に多数生息している表皮ブドウ球菌は,脂線に棲むアクネ菌から排出される脂肪酸と合わせて「皮脂膜」を作り皮膚表面を弱酸性に保っている。皮膚を弱酸性に保つことは,表皮ブドウ球菌自身のすみかを安泰にするとともに,弱アルカリ性を好む黄色ブドウ球菌やカビなどの増殖を抑制する。通常,菌類は悪臭のある遊離脂肪酸を産生するが,黄色ブドウ球菌やカビもこの例にもれない。表皮ブドウ球菌がこれらの菌数を抑制することにより,その遊離脂肪酸や,アンモニア,インドール等の悪臭も抑えている。表皮ブドウ球菌は人のスキンケアにもなくてはならない菌である。
また,やむを得ず皮膚を傷つけざるを得ない医療現場では,よい働きをするはずの表皮ブドウ球菌も主要な感染症起因菌となる。皮膚から血管内へカテーテルを挿入しているような場合である。表皮ブドウ球菌は,ポリサッカライド(ガラクトース,アラビノースなど)で構成されるアドヘシンとよばれる接着因子をもち,カテーテルのプラスチック表面に付着する。この付着菌がもとになって同種のみならず他種の菌とも手をつなぎ「バイオフィルム」とよばれる菌膜を形成する(後述)32)。できた菌膜は薬剤でも排除できず,菌血症を起こして血管カテーテルを取り除かなければならなくなる。このように常在菌は二面性をもっている。
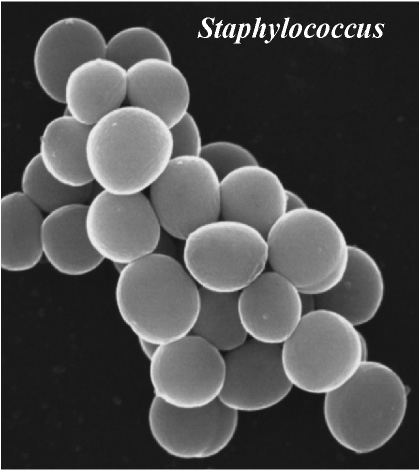 |
| Fig. 2 Scanning electron micrograph of Staphylococcus( photograph by Sakuo Yamada) |
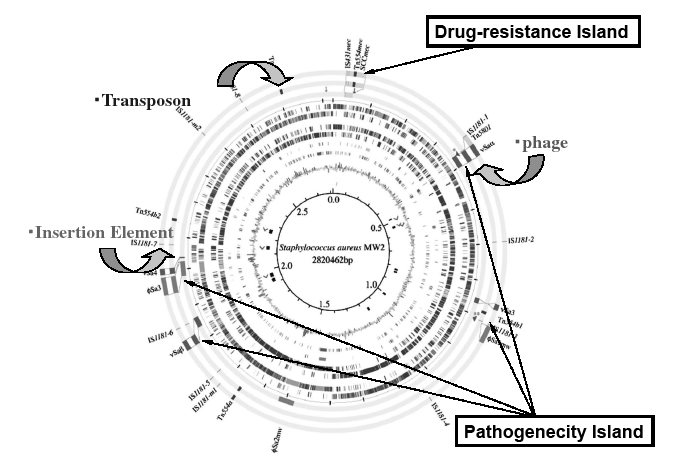 |
| Fig. 3 Genome of methicillin-resistant Staphylococcus aureus(MRSA)( modified figure from Reference No. 21). The locations of Drug-resistance Island, Pathogenecity Island, and mobile genes( phages, transposons, and insertion-elements) are shown on the designed staphylococcal genome circular. |
2-3 皮脂を食べるアクネ桿菌
もっとも多く皮膚に常在する菌種,アクネ桿菌(Propionibacterium acnes)(Fig. 3)は嫌気性の桿菌で,皮脂を非常に好むため皮脂分泌量が多い皮膚の毛包(毛穴)奥の脂線をすみかにしている。アクネ桿菌は皮脂を分解してプロピオン酸とよばれる脂肪酸とグリセリンを作る36)。この脂肪酸は,前述の表皮ブドウ球菌の出す脂肪酸とともに皮脂膜を形成して,病原菌などの侵入や紫外線から皮膚を保護している。
しかしながら,表皮ブドウ球菌と同様に,アクネ桿菌も皮膚を弱酸性に保って皮脂膜を形成し皮膚を保護するのにいなくてはならない役割と,化膿性の皮膚炎症(いわゆるニキビ)を起こすという役割の二面性をもっている。さまざまな要因により皮脂の分泌が過剰になると,毛包が詰まったりアクネ桿菌が過剰に増殖したりして,ニキビの原因になるのである。
2-4 醗酵化学国日本を支えた立役者
本来,農耕社会である日本では,古今東西,日本酒,焼酎,ワインなどの酒造りが盛んであり,その美味しさを競って産業化もされている。味噌,しょう油は日本特異の調味料である。また,ヌカみそ漬や沢庵をはじめとする各種野菜の漬物の旨味は日本人の味覚に極めてマッチしている。おそらく,これらの味の製造元は人ではなく麹菌という微生物であることを知らない人はいない。
酒造は,蒸したお米と水と麹菌・酵母菌がその材料であり,「杜氏」とよばれる酒造りの技をもつ職人の手のみが混ぜるためにこれらに触れることができる。酒造りが始まると,女人は現場の立ち入りすら許されなかった。また,味噌としょう油も,蒸したお米と麹菌と水に茹でた大豆が加わり醸造技術により造られる。機械化される前はこれらを混ぜるのは人の手であった。漬物の場合,とくにヌカみそ漬のヌカ床と野菜を混ぜるのは家庭の主婦の手である。したがって,どの場合も造る人の手に生息する常在菌が材料に入り込んでその味付けに関与していることが推察できる。ヌカみそ漬の味はその家によって味が違うことがよく知られる。これこそ,手に常在する菌の種類が人によって異なる37)結果生じる菌の仕業なのである。また,女人禁制の酒造は,女性のみに常在する味に影響する菌を排除するためなのであろう。常在菌種の構成は,性別,年齢,人種,食の嗜好,生活習慣などで異なっていることがそれを裏付けている。こうした手に棲むさまざまな常在菌は,四季折々の農作物と気温の変化がタイミングよく菌の代謝と醗酵を促し,生活の知恵として絶妙な味を綾なして醗酵化学の発展を支えていったのである。その詳細については本稿では割愛したい。
3. 鼻腔・咽頭常在菌叢
3-1 分布と特徴
鼻腔・咽頭は呼吸の入り口であるため,病原性をもつ多数の菌が出入りし,定着する場所である。しかしながら,これらの菌が定着しても必ずしも発病するとは限らない。常在菌の定義が難しい場所であるが,常時検出される菌を常在菌としている。好気性の黄色ブドウ球菌(Staphylococcus aureus),表皮ブドウ球菌(S. epidermidis),緑膿菌(Pseudomonas aeruginosa),肺炎桿菌(Klebsiella pneumoniae),肺炎球菌(Streptococcus pneumoniae),髄膜炎菌(Nisseria meningitidis),嫌気性のペプトストレプトコッカス(Peptostreptococcus)などがある。これらが数のバランスをとりながら生息している(Fig.1, Table 1)。優勢菌種の黄色ブドウ球菌は,高食塩濃度でも生育でき,薬剤環境でも生育できる耐性を獲得しやすい特性をもっている。一方,自然界のどこにでもいる緑膿菌は,湿潤環境を好み有機物の痕跡さえあれば増殖することができ,ほとんどの薬剤が効かない強いグラム陰性菌である。角質層で覆われる皮膚はそれ自身がヒトの外界からのバリアーになっているので,鼻腔・咽頭粘膜が人体内へ入る最初の関門になる。そこを棲みかにする黄色ブドウ球菌や緑膿菌は,もっとも環境変化に強い菌種であるといえよう。しかしながら,この二つの菌は,より強い菌に進化したがゆえに,免疫力が低下した人々の集団である病院内では,MRSAやMDRP(後述)として「院内感染」の起因菌となることも見逃すことができない。
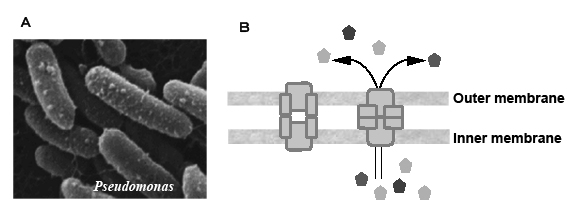 |
| Fig. 4 Scanning electron micrograph of Pseudomonas aeruginosa( photograph by Yoshichika Arakawa) and schematic mechanism of multi-drug resistant pump. |
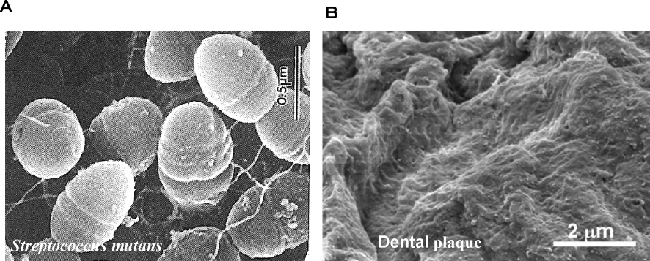 |
| Fig. 5 Scanning electron micrograph of Streptococcus mutans (photograph by Japanese Standard Microbiology ver. 6) (A)., and dental plaque by biofilm( photograph from website)( B). |
3-2 鼻腔粘膜の門番は塩好きの黄色ブドウ球菌
鼻咽腔にもっとも多く常在する菌の1つは,ブドウ球菌属の黄色ブドウ球菌(Staphylococcus aueus)である。黄色ブドウ球菌は,他のブドウ球菌と比べると7.5〜10%の高濃度食塩の中でも増殖がかのうであり17),血漿を凝集するコアグラーゼとよばれる酵素を産生することが特徴である。多くの菌の中で,ほとんどの菌は高濃度食塩中では生育できない。そこで,“しょっぱい”鼻水にさらされる鼻腔粘膜上に常在する菌の種類は限られる。食塩耐性の黄色ブドウ球菌にとって鼻腔は恰好のすみかになる。また,黄色のカロテノイド色素を産生するため,培地上では黄色のコロニー(集落)を作る。この色と形状からギリシャ語で学名のStaphyloは「ブドウの房状」,coccusは「球菌」,aureusは「黄金色」を意味している。黄色ブドウ球菌は,病気を起こす因子である多種多様な酵素類(コアグラーゼ,スタフィロキナーゼ,プロテアーゼ,リパーゼ,DNAaseなど)や毒素類(エンテロトキシン,TSST-I毒素,表皮剥離毒素,溶血毒ヘモリジン,ロイコシジンなど)の遺伝子をもち41),傷から体内に侵入してひとたびそれらが発現すると,正常な免疫をもつ健康な人でも感染症が惹起される。しかし,黄色ブドウ球菌が皮膚表面や鼻腔で生育する限りは何も起こらない。その病原性発現のしくみについては他項(7-1)で述べる。
3-3 可動性遺伝子をちりばめた黄色ブドウ球菌ゲノム
1929年A.フレミングにより発見されたペニシリンは,感染症から人類を救う夢の特効薬として一世を風靡した。しかし,その10年後には薬剤耐性菌が台頭し始め,その対策に世界中の医学研究者が苦悶したのはつい60年余り前のことである。1960年にはイギリスで初めてどんな薬剤も効かないメチシリン耐性黄色ブドウ球菌(Methicillin-resistant Staphylococcus aureus: MRSA)が見出された。MRSAは黄色ブドウ球菌がペニシリンと親和性が低いmecAとよばれる耐性遺伝子を取り込んだのだ15)。それから現在にいたる50年もの間,どこの病院でも院内感染菌MRSAとしてその対策に四苦八苦しているのである。このMRSAこそ,皮膚常在菌の黄色ブドウ球菌がヒトの体を通過して派生した菌である。今やMRSAは3割のヒトの鼻腔に常在する菌となっている29)。
菌自身を変幻自在に変えて環境変化に応答する黄色ブドウ球菌の研究に長年携わってきた筆者らは,そのゲノム配列解読から驚くべき黄色ブドウ球菌ゲノムの姿を明らかにした21)。そのゲノムには,薬剤耐性遺伝子群,腸管毒素群,プロテアーゼ群などの遺伝子群が,ブドウ球菌属に共通するゲノム骨格の数ヶ所にそれぞれ束になり他から移動して挿入されていたのである。これらの束を「アイランド」とよんでいる。つまり,その環境で生き残るために,いわば“生残戦略遺伝子”を可動性の遺伝子(プラスミド,トランスポゾン,ファージなど)を利用して移動し25),ゲノムに取り込んでしまったのだ。そして,つぎつぎに新しい毒素や薬剤耐性能を獲得して新型菌に進化していった。このように,黄色ブドウ球菌は,薬剤耐性遺伝子や各種の病原因子の遺伝子群を取り込んで薬剤環境でも適応できるように自身をMRSAに変えたのである。
3-4 バイオフィルム城内に棲む緑膿菌
緑膿菌(P. aeruginosa)も産生する色素とその形状から学名が命名されている。ギリシャ語でpseudoは「偽の」,monasは「鞭毛をもつ単細胞生物」,aeruginosaは「緑青色の」を意味する。緑膿菌(Fig. 6)は,少なくとも4種類の色素(ピオシアニン,ピオベルジン,ピオルビン,ピオメラニン),ムコイドとよばれる粘性のムコ多糖,分泌毒素(エキソトキシンA,溶血毒ヘモリジンなど),分泌酵素(エキソザイムS,プロテアーゼ,エラスターゼ,コラゲナーゼ,リパーゼなど)のさまざまな物質を産生して菌体外に分泌する14)。増殖した場所で緑膿菌は,粘性物質ムコイドを分泌して粘膜に接着し,膜状のバイオフィルムを形成して菌体を覆い包む33)。この緑膿菌の特性は,自身の生育環境を整えて増殖を図るのに好都合である。このように,緑膿菌を中心とした“城”が造られ,そこを生活の場として菌が効率よく生活している。バイオフィルムの内部では,薬剤などの低分子の化学物質も透過しにくく,他の微生物の干渉もなく,粘膜の白血球の攻撃からも逃げることができ,緑膿菌のよいの隠れ家になる。しかも自身の分泌する物質をその隠れ家内にしまい込むこともできる。また,バイオフィルムから遊離した緑膿菌は,伝達性プラスミドを利用して,メタロβ-ラクタマーゼ39)とよばれる薬剤不活化酵素遺伝子を取り込んだり,菌が本来もっている薬剤をくみ出す排出ポンプ11)(Fig. 6)の働きを亢進したりして,多剤耐性の菌に進化する。
ところが,同じように多種多様な物質を産生する黄色ブドウ球菌と同じ場所をシェアーしなければならない。「なわばり」争いがあれば宿主側も被害を被るはずであるが,通常,何事もなく宿主は他の病原菌の侵襲から守られている。このことから,粘膜上では平和共存が保たれていることがうかがえる。では,これら菌同士はどのようにそのなわばりを決めているのだろうか。緑膿菌にはクオラムセンシング(後述)とよばれるしくみがあることが知られる40)。そのシステムは,菌の多くの分泌物質の産生を支配し,菌の密度を決めている。黄色ブドウ球菌にも同じようなシステムが備わっている31)。おそらく菌同士がその空間を共有するために,このシステムの中で自らの菌数を制御して平和的に存在を維持していることが想像できる(後述)。
 |
| Fig. 6 Dental biofilm-formation process with some spesies( modified picture from website). |
4. 口腔常在菌叢
4-1 分布と特徴
口腔内は,ヒトが生命活動やエネルギー活動を維持するための栄養源を摂取する最初の入り口である。そのため,口腔常在菌はヒトが無菌の胎内から生まれ外界に接してすぐに定着を開始する。そして,常在菌叢は,授乳期,離乳食期,普通食期にいたる成長過程により変動する。また,普通食期の子供や成人でも食物の嗜好,生活習慣などにより口腔環境が変化することに伴って変動する。しかしながら,一般成人の口腔内に常在する菌種の優勢種は決まっている。口腔内の常在菌は,ほとんどがグラム陽性のレンサ球菌属(Streptococcus)でその種類は数種類におよぶ35)。中でもミュータンス菌(Streptococcus mutans)は歯垢によく見出され,虫歯(う蝕)の原因菌とされている4)。また,嫌気性でグラム陰性のポルフィロモナス属(Porphyromonas gingivalis)は歯肉溝(歯と歯肉の間)に生息し,カンジダ菌(Candida)の助けを借りて歯肉に侵入し歯周病を起こすとされている20)(Fig. 1, Table 1)。本菌は糖類を代謝できない。そのため,生育するにはアミノ酸や蛋白質が必要とされる。このアミノ酸が分解されたときに生ずる分解物(有機酸)の悪臭が歯周病の口臭の原因となる。他に少数であるが,バクテリオネーマ属(Bacterionema)や糸状菌などが常在する。口腔内に浮遊している菌種は700種以上の数があるといわれるものの,それらは,分泌と嚥下が繰り返される唾液により変動が激しく常在菌とはいえない。
4-2 強固なバイオフィルムマンションを造るミュータンス菌
虫歯の原因となるミュータンス菌(Streptococcus mutans)というのは,いったいどこから来たのだろうか? 冒頭に述べたように,紀元前の人類も虫歯になっている。しかも無菌の中からやってきた乳児の口腔内には常在しない。その起源は解らないが,少なくとも全ての大人がミュータンス菌をもっているから,無菌の乳児はこの大人である両親から口移しでもらうのであろう。このミュータンス菌はレンサ球菌属(Streptococcus)(Fig. 7)の仲間の一種である。
レンサ球菌属は,一般に酸素があってもなくても乳酸発酵によって生存エネルギーを得ている4)。通常,嫌気性菌以外の細菌は,糖類を代謝する呼吸(TCA回路)によって高いエネルギーを得ている。発酵によるエネルギー産生は呼吸の1/13位で低い。したがって,レンサ球菌属は低いエネルギーで生きる術に長けている。そこで,ミュータンス菌は,シュクロースやマルトースを発酵することにより乳酸を作って周囲を酸性にし,レンサ球菌属以外の菌種を寄せつけず,また,シュクロースからグルカンとよばれる多糖(グルコースのポリマー)を作って付着能を高めている。グルカンは歯の平滑面に対しても強く付着し,他のレンサ球菌属も含んだバイオフィルムを作って歯垢を形成する5) (Fig. 7)。バイオフィルムは,幾重にも階層になった強固な層で菌体を覆い込み,その中では菌の仲間が生活している(後述)。一個の菌体が浮遊しているよりも何かをより所として集まって共同生活するほうがエネルギーを使わなくて済むからである。バイオフィルム内の菌は,産生する乳酸により歯のエナメル質を溶かしていわゆる虫歯を作る。
 |
| Fig. 7 Electron micrograph of Escherichia coli( photograph by the Microbiology Society of Japan) |
5. 腸内常在菌叢
5-1 分布と特徴
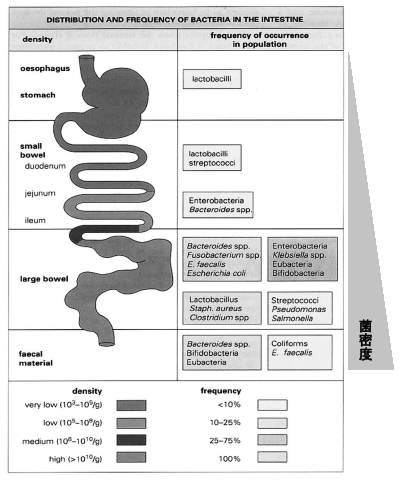
消化管の臓器である胃は,分泌する胃酸が強い酸(pH2)であるためほとんどの微生物は生存できない。しかしながら,多くの成人の胃にはピロリ菌(Helicobcter pylori)が少数常在する。ピロリ菌は,ウレアーゼとよばれる酵素の強い活性をもち,尿素を分解してアンモニアを産生し自身の周辺を中和しながら胃粘膜に潜り込んで生息している24)。小腸の上部も,胆汁やすい液の分泌により菌の数は少なく,乳酸桿菌(Lactobacillus),レンサ球菌(Streptococcus),ベイロネラ菌(Veillonella),などが少数見られる程度である。小腸下部にいくに従って菌種や菌数が増加する。
大腸になると,急激に多種多数の菌が存在するようになる。成人の大腸内では,培養可能な方法で調べても100菌種以上全部で100兆個(1014個)に及ぶ菌が生息している37)(Table 1)。多くの菌は嫌気性菌である。優勢菌種は,バクテロイデス属(Bacteriodes),ビフィドバクテリウム属(Bifidobacterium,ビフィズス菌ともいう),ペプトストレプトコッカス菌(Peptostreptococcus),クロストリジウム属(Clostridium),大腸菌(Escherichia coli),腸球菌(Enterococcus),セラチア菌(Serratia),その他の腸内細菌類などである(Fig. 1)。Fig. 8に示すように,これらのうちバクテロイデス属がもっとも多い。大腸菌や腸球菌など「腸」の和名称がつく菌は意外に少なく,全菌数の1%にも満たない。また,大腸内の常在菌叢や菌数は糞便のものとほぼ同じであるため,糞便の菌叢を調べれば大腸内の常在菌の状態を知ることができる。年齢別に腸内細菌叢を見てみると,新生児はたった1日で腸内菌叢が成立すること,乳児はビフィドバクテリウム属が優勢であること,普通食の子供と成人はバクテロイデス属が優勢種であること,老人はクロストリジウム属が優勢種となり数も減少する27)(Fig. 9)。このような多種多様な菌種が存在する腸内では,一定の菌バランスが維持されていれば「健康である」と見なされ,人体の健康を評価するために,腸内細菌叢を指標としたDNAアレイが開発され7),実用化されている。
 |
| Fig. 8 Cell density and distribution of human gut microbial flora( modified picture from Medical Microbiology) |
5-2 外敵監視システム= 粘膜免疫を支える腸内常
在菌叢
腸管内に棲む菌は,ほとんどが嫌気性菌で培養できない菌種が多い。しかしながら,近年の超高速DNAシーケンサーの登場は,培養に依存しない菌種の同定や遺伝子発現解析,機能解析を可能にし,1,000種におよぶ菌種の存在が予測されている12)。このように多くの腸内細菌叢はいったい何をしているのか,長い間,謎に包まれたままであった。近年の自然免疫の役者(TLR1)やNOD9),IgA,NK細胞)やそのしくみの解明と相まって,この数年の研究からやっと,そのベールがはがされつつある。
ヒトの腸管粘膜の表面積は400 m2にも及び,テニスコート1.5面に相当する広大な面積を有する。腸管内の細菌は,この広大な腸管粘膜のどこからでも生体内へ侵入する危険性があるために,腸管では特異な大きなリンパ組織が備わっていることが明らかになった。ヒトの腸管には1 m2あたり1010個以上の抗体産生細胞が存在しており,これは全身の抗体産生細胞のおよそ80%にも相当する。腸管は最大の免疫臓器であると言われる所以である。腸管上皮細胞(Fig. 10)にはパイエル板とよばれる腸管リンパ節があり,これまで注目されていた血液やリンパ節には見られない,新規の特異な免疫細胞が次々見出されたのである。抗菌ペプチドを産生するパネート細胞2),腸管上皮細胞間リンパ球19),インターロイキン高産生細胞,免疫系制御Treg細胞38),リンパ組織誘導細胞,IgA産生細胞などである。したがって,このように多種類の免疫細胞が集まっている腸管は,ストレス環境にもっとも著しい障害を受ける。しかも,これら消化管にいる免疫細胞群の分化や働きには,腸内常在菌の刺激が必要であること,これに対して各種の免疫受容体は,腸内常在菌叢の代謝産物をモニターしていること,腸内常在菌叢の構成や菌数の乱れが炎症性腸疾患,肥満,癌などの発症や悪性化に関わっていることなどが,マウスを用いた研究で明らかになってきた16)。これらのことは,腸内常在菌叢と腸管免疫系は相互に深く関わりながら恒常性を維持していることを如実に示している。
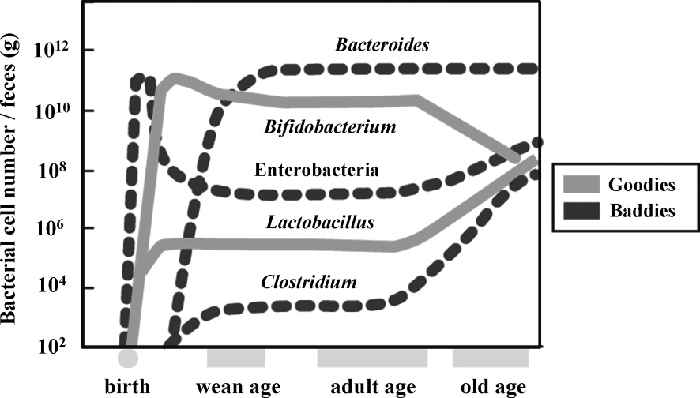 |
| Fig. 9 Species transition of human gut microbial flora as aging( picture by Hiroshi Ohno). |
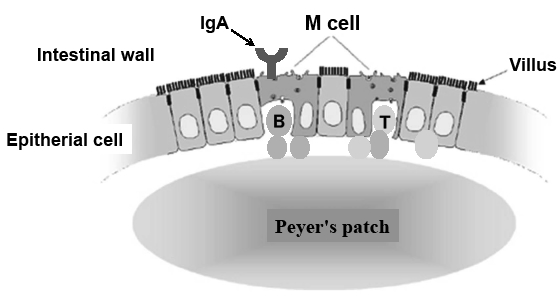 |
| Fig. 10 lymph system in intestinal epitheliocytes. Many kinds of immuno-lymphocytes are swarming at the epithelial cells. These are anti-peptide-produced paneth cells, IgA-produced cells, intraepithelial lymphocytes, high interleukin-produced cells, immuno-regulation Treg cells, lymphocyte induced cells, and so on. |
6. 生殖器の常在細菌叢
6-1 分布と特徴
女性の膣は外に向かって開いている。そこは無菌の子宮から生まれ出る胎児が通る産道になるところであり,新生児の初めての外部との接点となる場所である。健康な成人女性の膣内には,グラム陽性の乳酸桿菌8)(Lactobacillus acidophilus,デーデルライン桿菌ともよぶ)が多数生息する(Fig. 1, Table 1)。膣上皮には,女性ホルモンの働きによってグリコーゲンが蓄積するが,これらの乳酸菌ははがれた上皮細胞のグリコーゲンを栄養源として常在している。これらの菌が産生する乳酸によって膣内のpHは酸性に保たれており,他の病原細菌の侵入や増殖を抑えて膣の自浄作用を行い,バリヤーとしての役割を担っている。膣にはこのほかに少数であるが,スメグマ菌10)(Mycobacterium sumegmatis)やカンジダ菌(Candida)が常在しており,ホルモンバランスが崩れて免疫力が低下すると,乳酸桿菌の数が減少してカンジダ菌による炎症が起きる。また,隣接する皮膚や腸に棲んでいる菌が通過菌として出入りしているが,通常,乳酸桿菌の自浄作用でそれらの菌の数は抑えられている。
7. 運命共同体の自治会システム(クオラムセン
シングとバイオフィルム)
7-1 黄色ブドウ球菌の悪玉化シグナル: クオラム
センシング
細菌・真菌から植物まで普遍的に存在する「二成分制御系」とよばれるしくみがある26)。これは,細胞内情報伝達を担うシステムであり,細胞が外からの刺激に応じて生じる生理機能を遺伝子の発現レベルで制御して恒常性を維持する働きをしている。二成分制御系は,二種類の蛋白質,センサーヒスチジンキナーゼとレスポンスレギュレーターから構成されている。感知する刺激の種類や生じる生理機能の種類は多岐にわたるので,黄色ブドウ球菌では26種類21),大腸菌では30種類6)の二成分制御系をもっている。
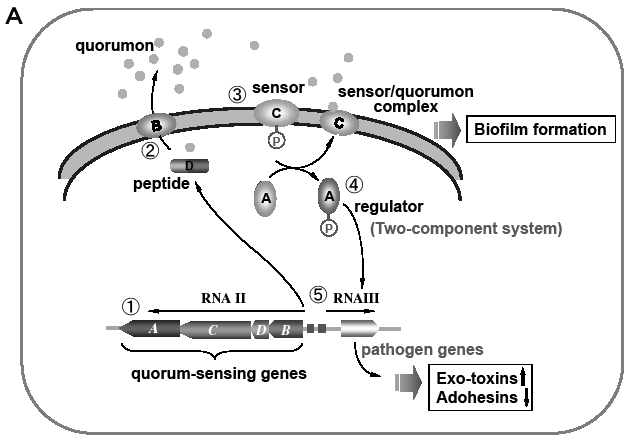
これらのうちの一つが「クオラムセンシング」とよばれる菌の密度を感知するシステムである。各種の病原因子を分泌することにより疾患を起こすブドウ球菌,レンサ球菌,緑膿菌などでは,クオラムセンシングのしくみがよく研究されている。毒素やプロテアーゼなどの病原因子の発現や,難治疾患となるバイオフィルム形成がこれに深く関わっているからである。菌種によりクオラムセンシングの呼び方はいろいろである。黄色ブドウ球菌の例をFig.11Aに示す。本菌のクオラムセンシング(Agr制御系31)とよぶ)は,センサー,レギュレーター,クオルモン,クオルモン合成酵素の4つのクオラム遺伝子が関与している。クオルモンというのは情報伝達物質(後述)である。そのしくみのステップは,次のように進む。①刺激に遺伝子が応答して発現する。②クオルモン遺伝子がコードするペプチド(D)を産生し,分泌装置(B)でペプチドを分解しながらクオルモン(環状ペプチド)として菌体外に分泌する。③センサー(C)はその刺激に応じて自己リン酸化(ATPのリン酸基を自身の活性部位ヒスチジンに付加する)する。④リン酸化により活性化したセンサーはクオルモンと結合してセンサー/クオルモン複合体をつくり,同時にリン酸基をレギュレーター(A)に転移する。⑤リン酸基を受け取ったレギュレーターは,クオラム遺伝子とその下流にある病原遺伝子群の発現を促す。センサー/クオルモン複合体は,菌細胞内外のクオルモンの濃度を感知することにより菌数の密度を認識する。その濃度が一定に達すると特定の物質が産生され,バイオフィルムが形成される。このクオラムセンシングこそ,黄色ブドウ球菌が病原遺伝子を持っているにもかかわらず通常生息する場所では病原性を示さないが,棲む場所が変わると病原性をもつ“悪玉菌に変身する”という悪玉化シグナルにほかならない。
グラム陰性菌では内膜と外膜があるため,クオラムセンシングの基本システムはもっと進化した形をとる。グラム陽性菌と対比させて緑膿菌の例40)を図に示す(Fig. 11B)。クオラムセンシングシステムは二つ(las系とRhl系)あり,それぞれクオルモン合成酵素とレギュレーターで構成される。クオルモンは内膜・外膜を自由に行き来してクオルモン/レギュレーター複合体を造り,バイオフィルム形成や病原因子の産生を促進している。
 |
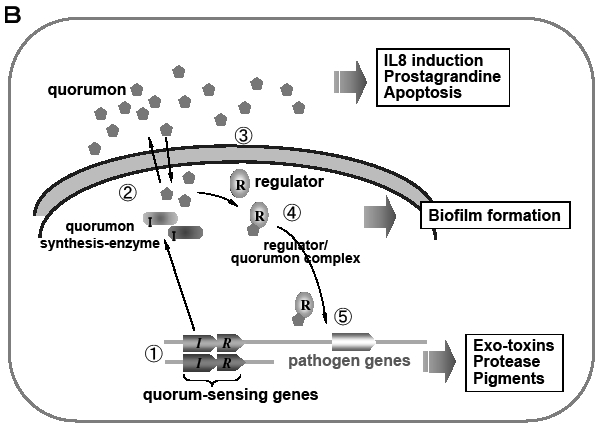 |
| Fig. 11 Conceptual pictures of Quorum-sensing system of Staphylococcus(A) and Pseudomonas(B) |
7-2 自治会のネットワーク: バイオフィルム
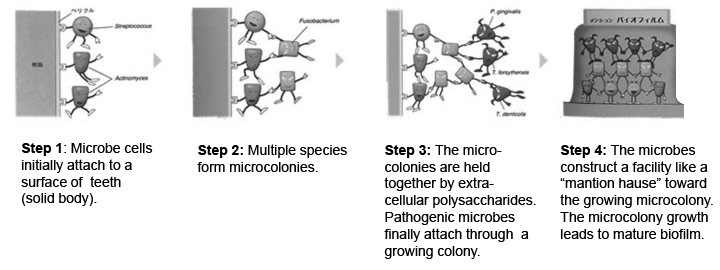
細菌は,固形物があると粘性のある多糖類を分泌して付着する性質をもつ。付着した菌はその場で増殖し,いろいろな菌種を巻き込んでぬめりのある構造体を形成する。これをバイオフィルムとよんでいる18)。バイオフィルムは,わずかな基質と水さえあれば自然界ではどこにでも存在する。医療の場で,体内に挿入されたカテーテルなどの器材にこれが形成されると,免疫も薬剤も効き目がなく大きな問題となる。ブドウ球菌,レンサ球菌,緑膿菌などは,そのバイオフィルムの基盤づくりの菌種として問題視されている。バイオフィルム内では,多種多様な菌種が生息しており,内部の菌密度は外部の数千倍におよぶこともある。近年,バイオフィルムの形成過程やその機能が明らかにされ,菌にも見事な“社会”があることが知られるようになった33)。
Fig. 12に示すように,その形成過程は,まず,① 基質に付着した細菌が多糖体(Extracellular polymeric substance:EPS)を細胞外に分泌する。② 各種の菌が付着し始め,定着と離脱を繰り返しながら菌数を増やして細菌の集落を形成する。③ 集まった菌は分泌したEPSで周囲を固め,構造体(バイオフィルム)が形成される。EPSはバリアーの役割をもち,内部の菌を外部環境から守る。そのため,バイオフィルムは閉鎖コロニーとなり,その中では高密度の菌が棲息している。一個より多勢で集まっているほうが生き残るのにエネルギーを使わなくすむからである。④ 内部の菌数が一定になると菌は離脱する。バイオフィルムを維持するには内部の住人の数を一定に保つ必要がある。つまり,内部では棲息する菌数がそれぞれ調整されているのだ。いわば,われわれの社会の町内会の自治会のように。この菌社会を管理・調節しているシステムが「クオラムセンシング機構」なのである(前述)。また,バイオフィルム内は外部の環境と大きく異なるため,内部で生息する菌はEPSを通じて栄養分や情報伝達物質のやり取りをしていると考えられている。
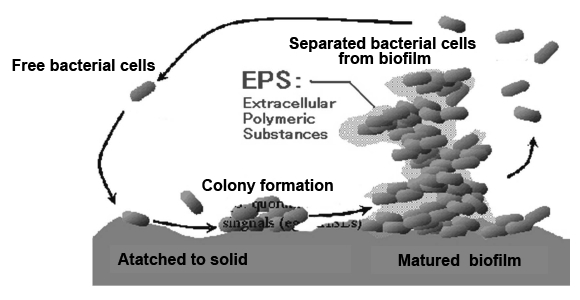 |
| Fig. 12 Schematic biofilm-forming process( picture from website) |
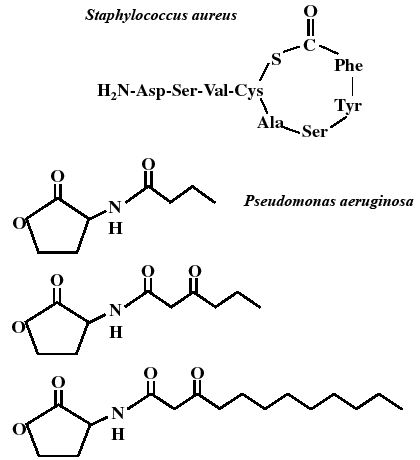 |
| Fig. 13 Chemical structure of quorumons( autoinducers) in Staphylococcus and Pseudomonas. |
7-3 情報伝達のことば: クオルモン
クオラムセンシングを行う細菌では,多くのグラム陰性菌はホモセリンラクトン類(AHL),グラム陽性菌は環状チオラクトンペプチド類が,情報伝達の手段=ことばとしての役割を果たしている(Fig. 13)。これらの物質をクオルモン(フェロモン,オートインデューサー,オートクラインともいう)33)とよんでいる。前項で述べたように,クオルモンを結合したセンサーは,菌細胞内外のクオルモンの濃度を感知することにより菌数の密度を認識する。その濃度が一定に達すると特定の物質(EPS)が産生され,各種の菌類を閉じ込めるバイオフィルムが形成される。バイオフィルム内の閉鎖社会では協調しなければ恒常性が保たれない。内部では種類の違う細菌や真菌まで同居しているという事実から,その“ことば”は競争原理に基づくものではなく,互換性のあるソフトで相互認識されているのかもしれない。閉鎖社会で生存するためには,生物の多様性もファジーにならざるを得ないであろう。
おわりに
ヒトという生命体を取り巻く各種の常在菌の関わりを見てきたが,ヒトの目には見えない微生物もそれぞれ社会を造り,ヒトと共生して生活している実態が見えたはずである。そして,常在菌叢の役割にはまったく相反する二面性があることに気がついたに違いない。つまり,ヒトから見れば,菌に餌と棲みかを提供することにより,常在菌は外部からの病原菌の侵入を阻止したり,免疫を活性化したり,人体を守ってくれるよい一面と,様々な環境変化により平衡が崩れると暴徒化してヒトを襲うというマイナス面があることである。通常,ヒトは常在菌叢のよい面で守られているという意義のほうが大きい。これら常在菌の両面の役割を考えると,巷にあふれる “菌を一掃する”という考え方がいかに間違っているかが解る。腸管粘膜は,大量の常在菌とヒトの最大の触れ合いの舞台である。その腸管粘膜で起きている常在菌とヒトの「共生」シナリオの全体像が明らかになれば,マイナス面の対策に大きな一石を投じることが期待できるであろう。そして,今後の腸管免疫の研究の進展は,免疫学にも新たなブレイクスルーを与えるに違いない。
文 献
| 1) | Akira, S., Uematsu, S. and Takeuchi, O.:Pathogen recognition and innate immunity. Nature, 441, 101-105, 2006. |
| 2) | Ayabe, T., Satchell, D.P., Wilson, C.L., Parks, W.C., Selsted, M.E. and Ouellette, A.J.:Secretion of microbicidal α-defensins by intestinal Paneth cells in response to bacteria. Nature Immunol., 1, 113-118, 2000 |
| 3) | Blow, N.:Metagenomics:exploring unseen communities. Nature, 453, 687-690, 2008. |
| 4) | Clarke, J.K.:On the bacterial factor in the etiology of dental caries. Brit. J. Exp. Pathol., 5, 141-147, 1924. |
| 5) | Costerton, J.W., Stewart, P.S. and Greenberg, E.P.: Bacterial biofilms:A common cause of persistent infections. Science, 284, 1318-1322, 1999. |
| 6) | Frederick, R.B., Plunkett III, G., Bloch, C.A., Perna, N.T., Burland, V., Riley, M., Collado-Vides, J., Glasner, J.D., Rode, C.K., Mayhew, G.F., Gregor, J., Davis, N.W., Kirkpatrick, H.A., Goeden, M.A., Rose, D.J., Mau, B. and Shao, Y.:The complete genome sequence of Escherichia coli K-12. Science, 277, 1453-1462, 1997. |
| 7) | Friedrich, T., Rahmann, S., Weigel, W., Rabsch, W., Fruth, A., Ron, E., Gunzer, F., Dandekar, T., Hacker, J., Muller, T. and Dobrindt, U.:High-throughput microarray technology in diagnostics of enterobacteria based on genome-wide probe selection and regression analysis. BMC Genomics, 11, 591, 2010.? |
| 8) | Gilliland, S. and Speck, M.:Deconjugation of bile acids by intestinal lactobacilli. Appl. Environ. Microbiol., 33, 15-18, 1977. |
| 9) | Girardin, S.E., Boneca, I.G., Carneiro, L.A.M., Antignac, A., Jehanno, M., Viala, J., Tedin, K., Taha, M-K., Labigne, A., Zathringer, U., Coyle, A.J., DiStefano, P.S., Bertin, J., Sansonetti, P.J. and Philpott, D.J.:Nod1 detects a unique muropeptide from gram-negative bacterial peptidoglycan. Science, 300, 1584-1587, 2003. |
| 10) | Gordon, R.E. and Smith, M.M.:Rapidly growing acid fast bacteria:I. Species’ descriptions of Mycobacterium phlei Lehmann and Neumann and Mycobacterium smegmatis (Trevisan) Lehmann and Neumann. J. Bacteriol., 66(1), 41-48, 1953. |
| 11) | Harris, A., Torres-Viera, C., Venkeataraman, L., DeGirolami, P., Samore, M. and Carmeli, Y.:Epidemiology and clinical outcome of patients with multiresistant Pseudomonas aeruginosa. Clin. Infect. Dis., 28, 1128-1133, 1999. |
| 12) | 服部正平:ヒトの腸内細菌叢の全体像?メタゲノム解析から見えてきたこと?,科学,78, 30-33, 2008. |
| 13) | Hattori, M. and Taylor, T.D.:The human intestinal microbiome:A new frontier of human biology. DNA Res., 16(1), 1-12, 2009. |
| 14) | Hirakata, Y., Furuya, N., Tateda, K., Matsumoto, T. and Yamaguchi, K.:The influence of exo-enzyme S and proteases on endogenous Pseudomonas aeruginosa bacteraemia in mice. J. Med. Microbiol., 43(4), 258-261, 1995. |
| 15) | Hiramatsu, K., Kondo, N. and Ito, T.:Genetic basis for molecular epidemiology of MRSA. J. Infect. Chemother., 2, 117-129, 1996. |
| 16) | 本田賢也:腸管フローラによる免疫ホメオスタシス,実験医学,29(18), 2932-2976, 2011. |
| 17) | Kanemasa, Y., Takatsu, T., Sasai, K., Kojima, I. and Hayashi, H.:The salt-resistance mechanism of Staphylococcus aureus examined by salt-sensitive mutants. Acta Med. Okayama, 30(4), 271-276, 1976 |
| 18) | Kaplan, H.B. and Greenberg, E.P.:Diffusion of autoinducer is involved in regulation of the Vibrio fischeri luminescence system. J. Bacteriol., 163, 1210-1214, 1985. |
| 19) | Kau, A. L., Ahern, P.P., Griffin, N.W., Goodman, A.L. and Gordon, J.I.:Human nutrition, the gut microbiome and the immune system. Nature, 474, 327-336, 2011. |
| 20) | Kuboniwa, M., Hendrickson, E.L., Xia, Q., Wang, T., Xie, H., Hacket, M. and Lamont, R.J.:Proteomics of Porphyromonas gingivalis within a model oral microbial community. BMC Microbiol., 9, 98, 2009. |
| 21) | Kuroda, M., Ohta, T., Uchiyama, I., Baba, T., Yuzawa, H., Kobayashi, I., Cui, L., Oguchi, A., Aoki, K., Nagai, Y., Lian, J., Ito, T., Kanamori, M., Matsumaru, H., Maruyama, A., Murakami, H., Hosoyama, A., Mizutani-Ui, Y., Kobayashi, N., Tanaka, T., Sawano, T., Inoue, R., Kaito, C., Sekimizu, K., Hirakawa, H., Kuhara, S., Goto, S., Yabuzaki, J., Kanehisa, M., Yamashita, A., Oshima, K., Furuya, K., Yoshino, C., Shiba, T., Hattori, M., Ogasawara, N., Hayashi, H. and Hiramatsu, K.:Whole genome sequencing of methicillin-resistant Staphylococcus aureus. Lancet, 357, 1225-1240, 2001. |
| 22) | Kurokawa, K., Itoh, T., Kuwahara, T., Oshima, K., Toh, H., Toyoda, A., Takami, H., Morita, H., Sharma, V.K., Srivastava, T.P., Taylor, T.D., Noguchi, H., Mori, H., Ogura, Y., Ehrlich, D.S., Itoh, K., Takagi, T., Sakaki, Y., Hayashi, T. and Hattori, M.:Comparative metagenomics revealed commonly enriched gene sets in human gut microbiomes. DNA Res., 14, 169-181, 2007. |
| 23) | Mardis, E.R.:Annual Review of Genomics and Human Genetics. 9, 387-402, 2008. |
| 24) | Marshall, B.J.:Unidentified curved bacilli in the stomach of patients with gastritis and peptic ulceration. Lancet, 1, 1273-1274, 1983. |
| 25) | Matthes, P. and Tomasz, A.:Insertional inactivation of the mec gene in a transposon muant of a methicillin-resistant clinical isolate of Staphylococcus aureus. Antimicrob. Agents Chemother., 34, 1777-1779, 1990. |
| 26) | Mitrophanov, A.Y. and Groisman, E.A.:Signal integration in bacterial two-component regulatory systems. Genes Dev., 22, 2601-2611, 2008. |
| 27) | 光岡知足:ヒトフローラ研究,腸内細菌学雑誌,19, 179-192, 2005. |
| 28) | Mullis, K.B. and Faloona, F.:Specific synthesis of DNA in vitro via a polymerase-catalyzed chain reaction. Methods Enzymol., 155, 335-350, 1987. |
| 29) | Naimi, T.S., LeDell, K.H., Boxrud, D.J., Groom, A.V., Steward, C.D., Johnson, S.K., Besser, J.M., O’Boyle, C., Danila, R.N., Cheek, J.E., Osterholm, M.T., Moore, K.A. and Smith, K.E.:Epidemiology and clonality of community acquired methicillin-resistant Staphylococcus aureus in Minnesota 1996-1998. Clin. Infect. Dis., 33, 990-996, 2001. |
| 30) | Nicogossian, A.E., Huntoon, C.L. and Pool, S.L.:Space Physiology and Medicine, 3 sub-edition. Lea & Febiger, Philadelphia, 1994. |
| 31) | Novick, R.P.:Autoinduction and signal transduction in the regulation of staphylococcal virulence. Mol. Microbiol., 48, 1429-1449, 2003. |
| 32) | O’Gara, J.P. and Humphreys, H.:Staphylococcus epidermidis biofilms:importance and implications. J. Med. Microbiol., 50(7), 582-587, 2001. |
| 33) | Parcek, M.R. and Greenberg, E.P.:Acyl-homoserine lactone quorum sensing in gram-negative bacteria:a signaling mechanism involved in associations with higher organisms. Proc. Natl. Acad. Sci. USA, 97, 8789-8793, 2000. |
| 34) | Proctor, L.M.:The human microbiome project in 2011 and beyond. Cell Host Microbe, 10(4), 287-291, 2011. |
| 35) | Rogers, A.H. (editor):Molecular Oral Microbiology. Caister Academic Press, 2008. |
| 36) | Rosenberg, E.W.:Bacteriology of acne. Annual Reviews, 20, 201-206, 1969. |
| 37) | 古田眞一,柳 雄介:戸田新細菌学。改訂32版,南江堂,2004. |
| 38) | Umesaki, Y. and Setoyama, H.:Structure of the intestinal flora responsible for development of the gut immune systemin a rodent model. Microbes Infect., 2, 1343-1351, 2000. |
| 39) | Wang, Chun-xin and Mi, Zu-huang:IMP-1 metallo-β-lactamase-producing Pseudomonas aeruginosa in a university hospital in the People’s Republic of China. J. Antimicrob. Chemother., 54(6), 1159-1160, 2004. |
| 40) | Whiteley, M., Kimberly, M.L. and Greenberg, E.P.:Iden-tification of genes controlled by quorum sensing in Pseudomonas aeruginosa. Proc. Natl. Acad. Sci. USA, 96, 13904-13909, 1999. |
| 41) | Whitt, D.D. and Salyers, A.A.:Bacterial Pathogenesis:A Molecular Approach. (2nd ed.), ASM Press, USA, 2002. |
| 42) | Woese, C.R., Kandlert, O. and Wheelis, M.L.:Towards a natural system of organisms:Proposal for the domains archaea, bacteria, and eucarya. Proc. Nati. Acad. Sci. USA, 87, 4576-4579, 1990. |
連絡先:〒305-8505 茨城県つくば市千現2-1-1
宇宙航空研究開発機構
宇宙飛行士運用技術部
宇宙医学生物学研究室
太田 敏子
TEL:050-3362-5527
FAX:029-868-3961
E-mail:ohta.toshiko@jaxa.jp