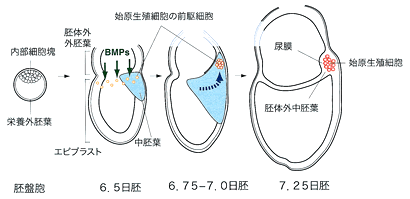
図1 マウス始原生殖細胞の形成過程
胚盤胞の内部細胞塊は着床後,エピブラストに発達する.エピブラスト基部には,胚体外外胚葉から分泌されるBMP4の作用により,始原生殖細胞の前駆細胞ができる.この前駆細胞は,原腸陥入開始後に胚の後端部の胚体外中胚葉領域に移動し,クラスターを形成する.この時,前駆細胞間ではEカドヘリンを介した相互作用がおこり,始原生殖細胞の分化決定が起こる.
加齢医学研究所雑誌第56巻第2号 平成17年2月
─────
総 説
─────
生殖細胞の分化決定と再プログラム化の分子機構
東北大学加齢医学研究所医用細胞資源センター
松居靖久
要 旨
マウスの胚発生過程で,配偶子のもとになる始原生殖細胞は,原腸陥入の直後に分化する.それに先だって,まず胚体外外胚葉から作用するBMP4の働きにより,多能性幹細胞の集団であるエピブラストの上端部に始原生殖細胞の前駆細胞が誘導される.前駆細胞は原腸陥入の開始とともに,胚の後端部の胚体外中胚葉に移動し細胞塊を形成し,細胞接着分子Eカドヘリンによる細胞間相互作用を受けて,始原生殖細胞へと最終的に分化決定される.ES細胞からは,単純な培養条件下で始原生殖細胞が分化することから,ES細胞と始原生殖細胞の前駆細胞は,似た性質を持っている可能性が考えられる.始原生殖細胞の分化過程では,ゲノム刷り込み遺伝子の脱メチル化が起こる.この脱メチル化は胚内を移動してきた始原生殖細胞が生殖隆起に入った後に急激に進行するが,その移動期から一部の脱メチル化がすでに始まっている.また,始原生殖細胞では全ゲノム的にもDNAが低メチル化状態になっており,生殖細胞の持つ特質と関連している可能性が考えられる.
加齢研誌56(2), 47-55, 2005.
はじめに
生殖細胞は個体を造りだすことができるという,体細胞にはない性質を持っており,生殖細胞の発生,分化過程で特異的に起こる変化によりそういった性質が獲得されると考えられる.生殖細胞の特性を裏付けている分子機構を考える上で興味深いポイントして,胚発生の初期段階で生殖細胞と体細胞が分岐するメカニズムが挙げられる.またひとたび分化した生殖細胞も,そのままで個体をつくり出す能力を持っているわけではなく,分化過程で体細胞では起こらないようなゲノムのエピジェネティックな変化,減数分裂,母性因子の蓄積等を経た後に,初めて個体発生能を獲得するに至る.この総説では特に,マウスの生殖細胞の分化決定のメカニズムと,ゲノムの再プログラム化の意義について解説する.
マウスの初期発生と始原生殖細胞の分化
ショウジョウバエやカエルなどいくつかの動物では,卵形成過程で蓄積・局在した母性決定因子によって,特定の割球が生殖細胞へ分化する.一方マウス等の哺乳動物では,着床後まで生殖細胞と体細胞の不可逆的な分岐は起こらないと考えられている1).卵割期から着床直後のマウス胚は,すべての体細胞および生殖細胞に分化する多能性幹細胞の集団と,胚体外組織に分化する細胞集団からなる.多能性幹細胞集団は,着床前の胚盤胞では内部細胞塊として存在し,着床後はエピブラスト (原始外胚葉) に発達する (図1).内部細胞塊やエピブラストのそれぞれの細胞は,多能性を保持していると考えられ,6.5日胚ころから始まる原腸陥入とともに内胚葉,中胚葉,外胚葉に分化する.またほぼ同じ時期に始原生殖細胞の分化も起こり,原腸陥入開始から約1日経った7.25日胚になると,アルカリフォスファターゼ (TNAP)2) およびPGC7/Stella3,4) といった特異的な遺伝子産物を発現する細胞集団として,分化決定を受けた始原生殖細胞が,胚の後端部分の胚体外中胚葉の内部に現れる (図1).
 |
図1 マウス始原生殖細胞の形成過程 |
始原生殖細胞の前駆細胞
エピブラストの限られた部分に局在した細胞が,始原生殖細胞に分化決定を受けることが,次に述べるような方法で解析された.原腸陥入開始前のエピブラスト内のひとつの細胞を色素で標識した後に全胚培養し,標識細胞がどのような細胞に分化するかが追跡された.その結果,エピブラスト上端部に位置している細胞の一部が,始原生殖細胞と尿膜に分化することが示され,この場所にこれらの両者に分化する前駆細胞が存在していることが示唆された (図1)5).一方,本来は神経などの外胚葉に分化するエピブラストの下端部分の細胞を取り出し上端部分に移植すると,移植した細胞は神経ではなく始原生殖細胞に分化し,その逆に上端部の細胞を下端部に移植すると,移植細胞は外胚葉に分化した6).これらのことから,原腸陥入前のエピブラストではどの場所にある細胞も始原生殖細胞に分化する能力を持っているが,エピブラスト上端部に位置することで,始原生殖細胞の前駆細胞としての性質を持つようになると考えられる.これらの結果から,エピブラスト上端部には,前駆細胞を誘導・維持するための環境が存在すると考えられた.その可能性をさらに解析するために,エピブラストから始原生殖細胞が分化する過程を再現できる初代培養系を確立した.そしてこれを使って,エピブラスト上端部に接している,将来胎盤などの胚体外組織に分化する胚体外外胚葉の誘導作用により,エピブラスト上端部の細胞が始原生殖細胞の前駆細胞として振る舞うようになることが明らかになった (図1).例えば,5.5日胚のエピブラストを単独で培養すると始原生殖細胞の分化は起こらないが,胚体外外胚葉をつけたままで培養すると分化が起こる7).
さらに胚体外外胚葉で発現しているBMP4が,この誘導作用を担っていることが示された (図1).BMP4は胚発生の様々な局面で,重要な役割を果たしている分泌性の因子だが,始原生殖細胞の前駆細胞ができる時期の胚体外外胚葉で特異的発現が見られ,またこの遺伝子をノックアウトしたマウスでは始原生殖細胞が形成されない8).さらに初代培養でも,組み換え型BMP4を培地に添加すると,胚体外外胚葉が存在しなくてもエピブラストから始原生殖細胞の分化が起こることがわかった9).これらの結果から,胚体外外胚葉から分泌されるBMP4が,エピブラスト細胞から始原生殖細胞の前駆細胞を誘導すると考えられる.さらに,より早い発生段階では,エピブラストはBMP4に対する反応性を持っておらず,まず胚体外外胚葉からの未知の因子の作用により,エピブラストの一部の細胞がBMP4に対する反応性を獲得すること,やがてこの反応性を持つ細胞がエピブラスト基部に局在することがわかった10).このように胚体外外胚葉が,それに接しているエピブラスト細胞に逐次的な誘導作用を及ぼすことにより,生殖細胞形成に向かった変化がはじまることがわかった.
始原生殖細胞の分化決定
先にも述べたように,エピブラスト内の前駆細胞は同時に尿膜にも分化し,またエピブラスト先端部に移植すれば外胚葉に分化するので,最終的な始原生殖細胞への分化運命の決定はまだ起こっていないことがわかる6).始原生殖細胞への分化決定はもう少し時間が経った7.25日胚頃に起こるが2,5),そのメカニズムを知るために,分化決定が起こる直前の前駆細胞の挙動を調べた.まず6.75日胚を断片化して培養し,この時期には前駆細胞は,もはやエピブラストではなく形成されて間もない胚体外中胚葉にすでに局在していることがわかった (図1)11).次に,始原生殖細胞をGFPの発現で識別できるOct3/4-GFPトランスジェニックマウスの6.75日胚の胚体外中胚葉断片を培養し,分化決定過程をタイムラプス解析により調べた結果,前駆細胞は一度細胞塊を作った後に始原生殖細胞に分化することが明らかになった11).さらに同様の胚断片の細胞を解離して培養すると始原生殖細胞が分化しないことがわかり,前駆細胞間の相互作用が生殖細胞の分化決定に重要な役割を果たしていることが考えられた11).
細胞間相互作用は,細胞表面に存在する膜蛋白質等を介して行われるが,始原生殖細胞の前駆細胞では,細胞接着分子であるEカドヘリンが係わっていることを見出した (図2).この分子は胚体外中胚葉内の前駆細胞クラスターで発現し,さらにその特異的な阻害抗体を培養に添加すると,前駆細胞からの始原生殖細胞の分化決定が起こらなくなることが明らかになった11).これらの結果から,Eカドヘリンに依存した細胞間相互作用により前駆細胞内に伝わったシグナルが分化決定を引き起こすものと考えられる.今後,そういったシグナル分子を同定することにより,生殖細胞の分化決定を直接制御する機構を解明できるのではないかと考えている.始原生殖細胞の前駆細胞塊では,やはり細胞間相互作用を担う可能性がある膜蛋白質をコードする遺伝子,fragillis/mil-1が発現しており4,12),Eカドヘリンとともに,分化決定に必要なシグナルを伝えている可能性が考えられる (図2).
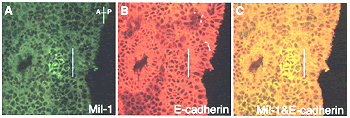 |
図2 始原生殖細胞の前駆細胞 |
このように,始原生殖細胞への分化決定が起こる際には,細胞外からのシグナルが重要な役割を果たしていることがわかるが,前駆細胞内で最終的に分化決定を引き起こす分子機構は,まだよくわかっていない.ショウジョウバエやカエル,線虫などでは,受精卵内に局在した生殖質をとりこんだ細胞が生殖細胞に分化し,そこに含まれる分子が分化決定に重要な役割を果たしていると考えられる1).しかし,生殖質に含まれる多くの遺伝子産物が同定されているものの,生殖細胞の分化決定に直接的に働く分子が何なのかはいまだはっきりわかっていない.一方,これらの生物の生殖細胞形成過程で共通して起こっていることの一つとして,転写が全体的に抑制されていることが挙げられている13,14).胚発生の初期段階では,多くの遺伝子産物の働きによりいろいろな体細胞組織が分化するが,生殖細胞では転写を全体的に抑えることによって,体細胞への分化を回避しているのではないかと考えられている.マウスにおいては,始原生殖細胞の分化決定が起こる前後で,そのような全体的な転写抑制が起こっているかどうかは明らかではないが,体細胞分化に重要な役割を果たすいくつかのホメオボックス遺伝子の発現が減少することが報告されている15).
ES細胞からの生殖細胞分化
以上に述べたように,胚発生過程での始原生殖細胞の分化決定は,かなり複雑な段階を経ているが,ES細胞から培養下で始原生殖細胞分化が起こることが報告され,この場合はより単純に分化決定が起こっているようにも思える (図3).ES細胞は内部細胞塊から樹立される多能性を保持した細胞株で,培養下で様々な組織の細胞へ分化することが数多く報告されているが,卵や精子にも分化することが報告された.ES細胞をフィーダー細胞もLIFもない条件で培養すると細胞は分化を始めるが,始原生殖細胞に特異的なマーカー遺伝子であるmVH (mouse vasa) の発現を調べると,培養開始後4日目までに一部の細胞での発現上昇が見られ,始原生殖細胞への分化が起こっていることがわかった.またさらに長期間培養することで卵や精子方向に分化することが報告された16−18).
すでに述べたように,胚発生過程では多段階にわたる組織および細胞間の相互作用によって起こる始原生殖細胞の形成が,ES細胞からはこのような比較的単純な培養条件で起こっている.その理由としてまず考えられることは,培養下でES細胞から分化した細胞が作り出す局所的な環境や細胞間相互作用が,胚の中でおこる複雑な現象を模倣できている可能性が考えられる.また,より興味深い可能性として,ES細胞は本来,始原生殖細胞の前駆細胞的な性質を一部持っていて,未分化状態の維持に働くLIF等の作用がなくなることで,直接的に始原生殖細胞に分化したといったことも考えられる (図3).胚の中では内部細胞塊は,体細胞への分化に適したエピブラストに一度分化するが,先に述べたような組織間,細胞間の相互作用により,始原生殖細胞への分化に適したより未分化な状態に戻る可能性が考えられる (図3).始原生殖細胞は特定の培養条件下では,多能性幹細胞に容易に変化するが19),このことも多能性幹細胞が始原生殖細胞の前駆細胞と似た部分があることに依っているとも考えられる.
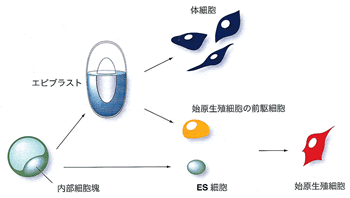 |
図3 多能性幹細胞と始原生殖細胞の関係 |
エピジェネティックな変化による生殖細胞核の再プログラム化
始原生殖細胞は配偶子に分化し受精して初めて,次世代個体を作るための全能性を発揮できるようになる.細胞の分化能の変化には,遺伝子発現を規定するクロマチン構造が大きな役割を果たしており,始原生殖細胞の分化過程や受精直後の胚では,クロマチン状態の変化に深く係わっているDNAやクロマチンの修飾
(エピジェネティックな修飾) 状態が体細胞では起こらないような変化を起こしていることがわかってきた.また,次に述べるように,ゲノム刷り込み遺伝子のメチル化の変化に関しては,数多くの論文が発表されている.
哺乳動物では,核移植などで人為的に作った卵子核あるいは精子核のみからなる二倍体の卵は,普通は正常な発生を行えないことが知られている.これは発生過程で重要な役割を果たすいくつかの遺伝子が,配偶子形成過程でゲノム刷り込みを受け,卵あるいは精子から受け継がれた一方の遺伝子のみが発生過程で転写活性化され発現するため,片親の核のみではそれら遺伝子群の発現が不完全なものになることによる
(図4).
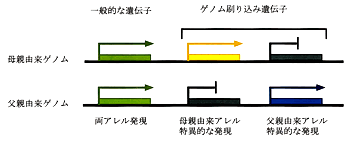 |
図4 ゲノム刷り込み |
このゲノム刷り込みには,DNAのメチル化が重要な役割を果たしている.たとえばゲノム刷り込み遺伝子Igf2rの場合,卵形成過程で特異的にメチル化され,一方,精子形成過程では脱メチル化状態に保たれる.そしてこのメチル化の特異性は,体細胞組織では個体の一生を通じて保たれ,メチル化を受けた,卵由来の遺伝子のみが発現する20).さらにメチル化酵素遺伝子の欠損により,刷り込み遺伝子のメチル化が影響を受けると発現も異常になることが示され,メチル化が刷り込み遺伝子の発現を直接制御していることが示された21).
卵あるいは精子形成過程で特異的なゲノム刷り込みが正しく行われるためには,配偶子形成過程でメチル化が起こることに先立って,親から受け継いだアレル特異的なメチル化が消去される必要がある.そして実際に始原生殖細胞の分化過程で,ゲノム刷り込み遺伝子の脱メチル化が起こることが示された
(図5).始原生殖細胞は,分化決定を受けた直後は胚の後端部分に存在しているが,その後,活発に増殖しながら器官形成が起こりつつある胚の中を移動する.そして卵巣,精巣の原基である生殖隆起が形成される時期に,その場所に達して生殖隆起に入る.いくつかのゲノム刷り込み遺伝子の始原生殖細胞でのメチル化状態が調べられ,始原生殖細胞が生殖隆起に入る時期に,それらの脱メチル化が急激に起こることがわかった22,23).このことから,生殖隆起の環境が脱メチル化の進行を引き起こす可能性が考えられる.一方,Igf2r遺伝子のメチル化領域
(DMR2) は,まだ移動している途中の一部の始原生殖細胞でも,脱メチル化が部分的に始まっていることを見出した (図5)24).これらの結果から,移動期から生殖隆起に定着した後にかけての始原生殖細胞では,ゲノム刷り込み遺伝子上の複数のメチル化部位の脱メチル化が,いくつかのメカニズムにより,非同調的に進行すると考えられる.
始原生殖細胞でのゲノム刷り込み遺伝子の脱メチル化が,核の発生能に影響を与えることが示されている.体細胞や多能性幹細胞の核は,除核卵に移植すると低頻度ながら成体にまで発生し,卵の中で初期化を受ければ個体発生能を獲得することが示されている25).一方,生殖隆起内で増殖休止期に入った雄の14.5-16.5日胚の生殖細胞では,ゲノム刷り込み遺伝子の脱メチル化はほぼ完了していると考えられるが,その核を移植した胚は9.5日胚で発生が止まり正常胚に比べて胚体が小さく,胎盤に異常が見られた26).発生段階がより早い,12.5,
13.5日胚の始原生殖細胞でも,ほぼ脱メチル化状態になっているが,この場合も核移植すると9.5日胚頃までしか発生が進まない22).また,さらにさかのぼった11.5,
10.5日胚の始原生殖細胞では脱メチル化が進行しつつある状態だが,その核を移植した胚はすくなくとも11.5日胚までは発生が進むことがわかった27).このように,ゲノム刷り込み遺伝子の脱メチル化が進むにつれ,始原生殖細胞の核の発生能が失われていくように思える.おそらく脱メチル化状態のゲノム刷り込み遺伝子は卵細胞質内でも正しくメチル化を受けることなく,それら遺伝子の発生過程での発現が乱れるために胚発生が異常になる可能性が考えられる.
生殖細胞の発生過程では,ゲノム刷り込み遺伝子に限らず全ゲノム的にDNAのメチル化の変化が起こっている.始原生殖細胞では移動期ではすでに低メチル化状態になっており28),その後,配偶子への分化過程で高メチル化状態へ変化する29).受精後,精子核と卵子核が融合する前に,まず精子核のDNAの脱メチル化が速やかに起こり,さらに両方の核が融合して卵割が進行する過程で,卵子核由来のDNAの脱メチル化が緩やかに進む29).このようなDNAのメチル化の変化が生殖細胞の性質とどのようなかかわりを持っているのかは,いまのところはっきりしたことはわかっていない.しかし,DNAのメチル化はヒストンのメチル化やアセチル化と関連しあいながら,クロマチン構造の変化の制御に重要な役割を果たしていることが明らかにされており,生殖細胞の分化過程では特異なクロマチン構造の変化が起こり,それがその後の全能性の獲得を深く係わっている可能性が考えられる.
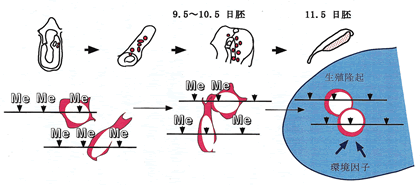 |
図5 始原生殖細胞でのゲノム刷り込み遺伝子の脱メチル化 |
おわりに
生殖細胞の発生機構のうち,この細胞のもつ特異な性質と密接に関連していると考えられる,胚発生段階における生殖細胞の発生運命決定と,その後の分化段階における生殖細胞核で起こるDNAのメチル化の変化について,主に取り上げた.発生運命に関しては,これまでの研究から細胞の外から働きかける因子により分化決定の前段階でどのようなメカニズムが働いているかが明らかになってきたが,今後は細胞内で直接的に分化決定を引き起こす分子カスケードを解明することが重要であると思われる.始原生殖細胞で起こるDNAの脱メチル化については,そのメカニズムとしてDNA複製時にメチル化が維持されないことに主によっているのか,あるいは,未だ同定されていないDNAを能動的に脱メチル化する因子が存在するのかを明らかにすることに興味がもたれる.また,特に全ゲノム的なメチル化の変化は,そのような変化が生殖細胞の核の状態の制御を通じて,全能性の獲得にどのようにかかわっているのかを解明することが,今後の課題であると考えられる.
文 献
1) Wylie C. Germ cells. Cell 96:165-174, 1999.
2) Ginsburg M, Snow MH, McLaren A. Primordial germ cells
in the mouse embryo during gastrulation. Development 110:521-528, 1990.
3) Sato M, Kimura T, Kurokawa
K, Fujita Y, Abe K, Masuhara M, Yasunaga T, Ryo A, Yamamoto M, Nakano T. Identification
of PGC7, a new gene expressed specifically in preimplantation embryos and germ
cells. Mech. Dev 113:91-94, 2002.
4) Saitou M, Barton SC, Surani MA. A molecular programme
for the specification of germ cell fate in mice. Nature 418:293-300, 2002.
5) Lawson KA, Hage WJ. Clonal
analysis of the origin of primordial germ cells in the mouse. Ciba Found Symp 182:68-84, 1994.
6) Tam PP, Zhou SX. The allocation of epiblast cells
to ectodermal and germ-line lineages is influenced by the position of the cells
in the gastrulating mouse
embryo. Dev Biol 178:124-132, 1996.
7) Yoshimizu T, Obinata M, Matsui M. Stage-specific
tissue and cell interactions play key roles in mouse germ cell specification. Development 128:481-490, 2001.
8) Lawson KA, Dunn NR, Roelen BA, Zeinstra LM, Davis
AM, Wright CV, Korving JP, Hogan BL. Bmp4 is required for the generation of primordial
germ cells
in the mouse embryo. Genes Dev 13:424-436, 1999.
9) Hayashi K, Kobayashi T,
Umino T, Goitsuka R, Matsui Y, Kitamura D. SMAD1 signaling is critical for
initial commitment of germ cell lineage from mouse epiblast. Mech Dev 119:99-109,
2002.
10) Okamura D, Hayashi K, Matsui M. Mouse epiblasts change
responsiveness to BMP4 signal required for PGC formation through functions of
extraembryonic
ectoderm. Mol Reprod Dev 70:20-29, 2004.
11) Okamura D, Kimura T, Nakano T,
Matsui Y. Cadherin-mediated cell interaction regulates germ cell determination
in mice. Development 130:6423-6430, 2003.
12) Tanaka SS, Matsui Y. Developmentally regulated expression
of mil-1 and mil-2, mouse interferon-induced transmembrane protein like genes,
during formation
and differentiation of primordial germ cells. Mech Dev 119S:S261-S267, 2002.
13) Seydoux G, Mello CC, pettitt J, Wood WB, Priess JR,
Fire A. Repression of gene expression in the embryonic germ lineage of C.elegans. Nature 382:713-716,
1996.
14) Leatherman JL, Levin L, Boero J, Jongene TA. germ cell-less
act to repress transcription during the establishment of the Drosophila germ
cell
lineage. Curr Biol 12:1681-1685, 2002.
15) Saitou M, Payer B, Lange UC, Erhardt S, Sheila CB,
Surani MA. Specification of germ cell fate in mice. Phil Trans R Soc Lond B 358:1363-1370, 2003.
16) Hubner
K, Fuhrmann G, Christenson LK, Kehler J, Reinbold R, De La Fuente R, Wood J,
Strauss III JF, Boiani M, Scholer HR. Derivation of oocytes from mouse embryonic
stem cells. Science 300:1251-1256, 2003.
17) Toyooka Y, Tsunekawa N, Akatsu R, Noce T. Embryonic
stem cells can form germ cells in vitro. Proc Natl Acad Sci USA 100:11457-11462, 2003.
18) Geijsen
N, Horoschak M, Kim K, Gribnau J, Eggan K, Daley GQ. Derivation of embryonic
germ cells and male gametes from embryonic stem cells. Nature 427:148-154,
2004.
19) Matsui Y., Zsebo KM, Hogan BLM. Derivation of pluripotential
embryonic stem cells from murine primordial germ cells in culture. Cell 70:841-847, 1992.
20) Brandeis M, Kafri T, Ariel M, Chaillet JR, McCarrey
J, Razin A, Cedar H. The ontogeny of allele-specific methylation associated with
imprinted genes in
the mouse. EMBO J 12:3669-3677, 1993.
21) Hata K, Okano M, Lei H, Li E. Dnmt3L
cooperates with the Dnmt3 family of de novo DNA methyltransferases to establish
maternal imprints in mice. Development 129:1983-1993, 2002.
22) Lee J, Inoue K, Ono R, Ogonuki N, Kohda T, Kaneko-Ishino
T et al. Erasing genomic imprinting memory in mouse clone embryos produced from
day 11.5 primordial
germ cells. Development 129:1807-1817, 2002.
23) Hajkova P, Erhardt S, Lane
N, Haaf T, el-Maarri O, Reik W, Walter J, Surani MA. Epigenetic reprogramming
in mouse migratory primordial germ cells. Mech Dev 117:15-23, 2002.
24) Sato S, Yoshimizu T, Sato E, Matsui Y. Erasure of
methylation imprinting of Igf2r during mouse primordial germ-cell development. Mol
Reprod Dev 65:41-50,
2003.
25) Wakayama T, Perry AC, Zuccotti M, Johnson KR, Yanagimachi
R. Full-term development of mice from enucleated oocytes injected with cumulus
cell nuclei. Nature 394:369-374, 1998.
26) Kato Y, Rideout WM, 3rd Hilton K, Barton SC, Tsunoda
Y, Surani MA. Developmental potential of mouse primordial germ cells. Development 126:1823-1832, 1999.
27) Yamazaki Y, Mann MR, Lee SS, Marh J, McCarrey JR,
Yanagimachi R, Bartolomei MS. Reprogramming of primordial germ cells begins before
migration into the
genital ridge, making these cells inadequate donors for reproductive cloning. Proc
Natl Acad Sci USA 100:12207-12212, 2003.
28) Seki Y, Itoh K, Mizugaki M, Saitou M, Matsui Y. Dynamic
genome-wide changes in chromatin structure in forming and early differentiating
mouse primordial
germ cells. Dev. Biol., in press.
29) Reik W, Dean W, Walter J. Epigenetic
reprogramming in mammalian development. Science 293:1089-1093, 2001.
Specification of germ cells and subsequent epigenetic changes during their differentiation
Yasuhisa MATSUI
Cell Resource Center for Biomedical Research, Institute of Development,
Aging
and Cancer, Tohoku University
In mouse embryos, primordial germ cells
(PGCs) are specified from a pluripotential cell population during gastrulation. As
an initial step of PGC specification, precursor cells are induced by
tissue interaction following implantation. This induction is mediated by bone
morphogenetic
protein (BMP) signals from the adjacent extra-embryonic ectoderm, and
the
induced PGC precursor cells localize in the proximal epiblast. During gastrulation,
PGC precursor cells move to the posterior end of the embryo and form
a cluster in the extra-embryonic mesoderm. In this cluster, the precursor cells
express
cell adhesion molecule E-cadherin, and the cell-cell interactions mediated
by this molecule play an essential role in final PGC specification. PGCs
can
be generated from embryonic stem (ES) cells in a simple monolayer culture. This
raises the possibility that ES cells are more closely related to the
PGC
precursors than epiblast cells.
During germ cell differentiation, the genome undergoes specific epigenetic
modifications. These include demethylation of imprinted genes and subsequent
establishment of parental allele-specific methylation. Some methylation
sites with an imprinted gene start demethylation in some migrating PGCs,
and the
progression of demethylation is rapid after colonization of the genital
ridges. PGCs also undergo genome-wide demethyation that correlates to developmental
potential
of their nucleus.
Key words:Primordial germ cell, pluripotential cell, E-cadherin, genomic imprinting, DNA methylation
Kareiigaku Kenkyusho Zasshi 56(2), 47-55, 2005.