1)『PETを用いた放射線治療計画
〜東北大学における現状とこれからの展望〜』
神 宮 啓 一・武 田 賢
Katja Lindel・目 時 隆 博
藤 本 圭 介・奈良崎 覚太朗
小 川 芳 弘・有 賀 久 哲
坂谷内 徹・高 澤 千 晶
山 田 章 吾
Introduction
FDG-PETは2002年より保険適応となったが,PET画像のみでは空間分解能も低く,詳細な解剖学的位置の同定が困難であった。しかし,PET/CTによりほぼ同時に同じ姿勢のPET画像・CT画像が得られ,これらを誤差0.5 mm以下でfusionできることで解決した。
直腸癌の約9%で局所再発を認める1)。その場合,第1選択は仙骨合併骨盤内臓全摘術である(R0では5年生存率;30〜50%)2,3)。局所再発症例の半分は,他臓器転移を認めず局所再発巣だけで死亡することから,局所制御による延命効果が望める4)。しかし,術後のQOLの低下が指摘されている。
直腸癌術後局所再発では術後瘢痕と再発腫瘤の鑑別が困難な場合が多々あり,これらが混在することが多い。Huebner et al.によると,FDG-PETの局所再発の感度94.5%,特異度97.7%,正診率95.9%で,術後瘢痕との鑑別に有効であり,従来の診断装置よりも有意に勝った5)
当院の取り組みとして,直腸癌術後局所再発症例にFDG-PET/CTplanningを行っている。その利点として,①術後瘢痕と再発腫瘤の鑑別が可能,②活動性の高い領域を同程可能,③骨盤壁に癒着している場合が多く,呼吸性の移動などを考慮する必要がない,などが挙げられる。
今回,PET/CT planningに関して,以下の2つの初期研究を行ったので報告する。
Study 1
Purpose 1
CTによるGTV(GTV-CT)とFDG-PET/CTによるGTV(GTV-PET)の比較を行った。
Materials and Methods 1
4時間以上の絶食下でFDG(約3.1 MBq/kg)を静注。1時間の安静後に排尿し,放射線治療時と同姿勢をとり撮像(図1)。
吸収補正のためのtransmission scanをCTで行った後に,emission scanを7ポジションで行ったが,骨盤部をはじめに行った。
CT画像とPET画像をDICOMデータにてそれぞれEclipse (Varian)に送り,DICOM情報によるfusionを行った。
図1
独立した放射線治療医4人が,それぞれGTV-CTとGTV-PETを囲い,GTV-CTの平均体積とGTV-PETの平均体積を7症例で比較した。FDGの異常集積範囲は主にTumor/Muscle比を参考に肉眼的にdelineateした。Modalityを被験者内要因,放射線腫瘍医を被験者間要因とし,二元配置分散分析法を用いた。
Results 1
GTV-CT; 94.2 cm3,GTV-PET;64.1cm3となり,GTV-PETがGTV-CTより統計学的に有意な減少を認めた(p<0.001;表1)。
放射線腫瘍医間では明らかなvolume差は認めなかった。modalityに主効果を認め,交互作用は認めなかった。
表1
| 症例 |
GTV-CT mean |
GTV-PET mean |
SUV≧2.5(cm3) |
SUV≧2.0(cm3) |
SUV≧1.5(cm3) |
| 1 |
47.6 |
25.9 |
4.8 |
6.9 |
10.9 |
| 2 |
164.9 |
144.4 |
47.6 |
79.6 |
131.7 |
| 3 |
55.3 |
20.2 |
3.1 |
5.8 |
13.7 |
| 4 |
63.1 |
29.6 |
0 |
0.6 |
10.3 |
| 5 |
107.9 |
52.8 |
2.3 |
7.9 |
25 |
| 6 |
170.0 |
134.6 |
3.6 |
12.8 |
51.9 |
| 7 |
50.8 |
41.4 |
0.1 |
3.1 |
15.1 |
Conclusions 1
T/M比較法でdelineationを行うと,GTV-CTとGTV-PETに有意差を認めた。
現時点ではCTV (GTV-CTとGTV-PET/CTをあわせた領域+5 mm)に均一に60〜66 Gyを処方している。
Introduction 2
これまでPTV-(PET+CT)にconventionalに2 Gy/fr・5 fr/weekで60〜66 Gy照射してきた。しかし,直腸癌では低酸素領域が多いため放射線抵抗性と考えられている6)。
当科藤本が行った直腸癌再発症例のretrospectiveな調査で,66 Gyより多く処方された症例で66 Gy未満の症例より有意に粗生存率及び局所制御率が高かったことや当科高橋が行った直腸癌再発症例への定位放射線療法により生存率の改善を認めていることなどから,dose-escalationの有効性が考えられた7)。しかし,critical organである小腸のため,安易な線量増加は危険であり,IMRTを用いてfocal dose-escalationを試験的に行った。
Study 2
Purpose 2
IMRTを用いてSUV1.5 以上の領域にfocal dose-escalationが可能であるかpreclinicalに検討した。
Materials and Methods 2
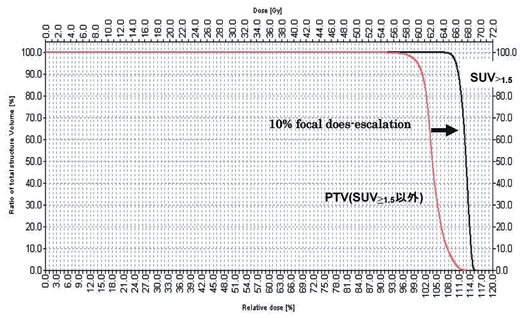
8症例において,GTV+5 mm=CTV, CTV+5 mm=PTVとして,SUV1.5+5 mm(PTV-PET)>66 Gy/30 fr, PTV-CT>60 Gy/30 fr, critical organ<60 Gy/30 frとなるようにinverse planningを施行。
治療計画装置はEclipse (Varian)を,X線はリニアック15 MV固定5門を用いた。
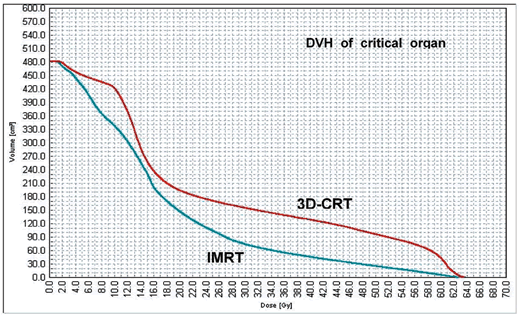
DVHにてconventional RT 60 Gy/30 frとの比較を行った。
Results 2
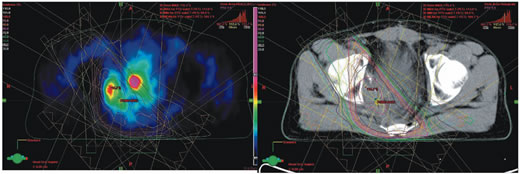
図2に一例を示した。骨盤臓器に対して,V50Gy-CRT vs V50Gy-IMRT; 11.3±3.2% vs 5.9±3.0%,V60Gy-CRT vs V60Gy-IMRT; 1.5±1.3% vs 1.4±1.1%,Dmean-CRT vs Dmean-IMRT; 23.3±6.2 Gy vs 18.1±4.5 Gy (p=0.006, p=0.87, p=0.08, resplectively; T検定)となった。
以上からSUV≧1.5+5 mmにIMRTで66 Gy/30 fr処方しても,CRTによる60 Gy/30 frと比較して,pelvic organのV50 Gyを有意に減量することが可能であり,かつV60Gy およびDmean に有意差はなかった。
Conclusions 2
IMRTを用いたFDG高集積領域に対する10%(6 Gy)のfocal dose-escalationは,critical organの合併症のriskを増やすことなく可能と思われる。
Discussion
Eclipse (Varian)ではSUV表示が不可能であるが,Bq/mlにて集積表示される。そのため,そのSUV表示の代用法として,SUV=集積(Bq/ml)/投与線量(Bq)/体重(g)であることか,表示windowとlevelをWindow=表示(SUV upper−low
er)×投与線量(Bq)/体重(g),Level=表示(SUV upper+lower)/2×投与線量(Bq)/体重(g)とすることで任意のSUV値による閾値設定が可能である。
どの程度の集積までが腫瘍細胞によるのかPETでの判断は困難である。腫瘍局在による炎症反応にもFDG集積亢進あり,正常消化管にも軽度集積亢進ある。これまでSUV閾値に関する報告もあるが,いまだ結論はない状況である (この研究ではSUV≧1.5=CTV-PETとした)。
PET/CTのfusionのずれ(体動・腸管蠕動運動や尿量・ベッドのたわみ)やHot urineによるartifactの問題もあるが,骨盤からのPET撮像を行うことで,ある程度の解決にはなると考える。
Dose-painting using IMRT
図2
Study 2からは,更なるdose-escalation(例えばFDG集積亢進域には69〜72 Gy/30 fr)が可能かもしれないが,それは今後検討する。また当施設では独自の低酸素マーカーであるF18-FRPが臨床試験中であり8,9),このような薬剤を使った低酸素領域へのfocal dose escalationにも期待できる。
Reference
1) 大腸癌治療ガイドライン 医師用2005年版,大腸癌研究会,2005.
2) Bergamaschi R, Pessaux P, Burtin P, et al: Abdominoperineal resection for locally ecurrent rectal
cancer. Tech Coloproctol 5: 97-102, 2001.
3) Weiser MR, Landmann RG, Wong WD, et al: Surgical Salvage of Recurrent Rectal Cancer after
Transanal Excision. Dis Colon Rectum 48: 1169-1175, 2005.
4) Gunderson LL, Sosin H: Area of failure found at reoperation following‘curative surgery’
for adenocarcinoma of the rectum. Cancer 34: 1278-1292, 1974.
5) Huebner RH, Park KC, Shepherd JE, et al: A metaanalysis of the literature for whole-body FDG-PET
detection of recurrent colorectal cancer. J. Nucl. Med. 41: 1177-1189, 2000.
6) Wedling P, Manz R, Thews G, et al: Heterogeneous oxygenation of rectal carcinomas in humans:A
critical parameter for preperative irradiation ? Adv. Exp. Med. Boil. 180: 293-3000, 1984.
7) 藤本圭介,小川芳弘,有賀久哲,他: 直腸癌局所再発症例に対する放射線治療.第66回日医放総会
8) Ishikawa Y, Funaki Y, Iwata R, et al: Development of [18F] FRP-170 injection for imaging hypoxia
by PET. Kaku Igaku 42: 1-10, 2005.
9) Kaneta T, Takai Y, Iwata R, et al: Initial evaluation of dynamic human imaging using 18F-FRP170
as a new PET tracer for imaging hypoxia. Ann Nucl med. 21: 101-107, 2007.