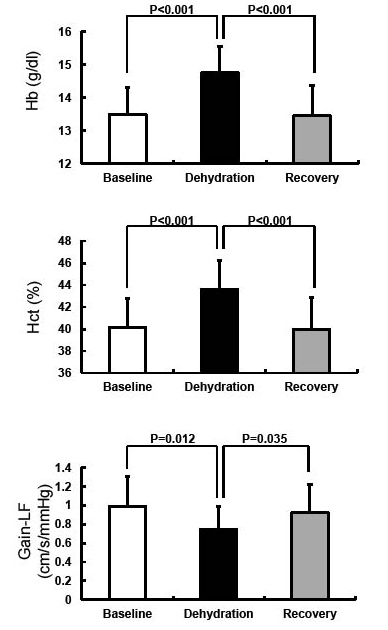
The Changes of Recovery from Dehydration by Rapid Infusion on Cerebral Autoregulation
| 1) |
Aaslid, R., Newell, D.W., Stooss, R., Sorteberg, W. and Lindegaard, K.F.:Assessment of cerebral autoregulation dynamics from simultaneous arterial and venous transcranial Doppler recording in humans. Stroke, 22, 1148-1154, 1991. |
| 2) |
Alfrey, C.P., Udden, M.M., Leach-Huntoon, C., Driscoll, T. and Pickett, M.H.:Control of red blood cell mass in spaceflight. J. Appl. Physiol., 81, 98-104, 1996. |
| 3) |
Buckey, J.C. Jr., Lane, L.D., Levine, B.D., Watenpaugh, D.E., Wright, S.J., Moore, W.E., Gaffney, F.A. and Blomqvist, C.G.:Orthostatic intolerance after spaceflight. J. Appl. Physiol., 81, 7-18, 1996. |
| 4) |
Dill, D.B. and Costill, D.L.:Calculation of percentage changes in volumes of blood, plasma, and red cells in dehydration. J. Appl. Physiol., 37, 247-248, 1974. |
| 5) |
Fritsch-Yelle, J.M., Whitson, P.A., Bondar, R.L. and Brown, T.E.:Subnormal norepinephrine release relates to presyncope in astronauts after spaceflight. J. Appl. Physiol., 81, 2134-2141, 1996. |
| 6) |
Giller, C.A.:The frequency-dependent behavior of cerebral autoregulation. Neurosurgery, 27, 362-368, 1990. |
| 7) |
Giller, C.A., Bowman, G., Dyer, H., Mootz, L. and Krippner, W.:Cerebral arterial diameters during changes in blood pressure and carbon dioxide during craniotomy. Neurosurgery, 32, 737-741, 1993. |
| 8) |
Giller, C.A. and Giller, A.M.:A new method for fixation of probes for transcranial Doppler ultrasound. J. Neuroimaging, 7, 103-105, 1997. |
| 9) |
岩崎賢一:変動解析(心拍,血圧,脳血流),日本臨床麻酔学会誌,28, 889-899, 2008. |
| 10) |
Iwasaki, K., Levine, B.D., Zhang, R., Zuckerman, J.H., Pawelczyk, J.A., Diedrich, A., Ertl, A.C., Cox, J.F., Cooke, W.H., Giller, C.A., Ray, C.A., Lane, L.D., Buckey, J.C. Jr., Baisch, F.J., Eckberg, D.L., Robertson, D., Biaggioni, I. and Blomqvist, C.G.:Human cerebral autoregulation before, during and after spaceflight. J. Physiol., 579, 799-810, 2007. |
| 11) |
Kemmotsu, O., Ueda, M., Otsuka, H., Yamamura, T., Winter, D.C. and Eckerle, J.S.:Arterial tonometry for noninvasive, continuous blood pressure monitoring during anesthesia. Anesthesiology, 75, 333-340, 1991. |
| 12) |
Lindegaard, K.F., Lundar, T., Wiberg, J., Sjøberg, D., Aaslid, R. and Nornes, H.:Variations in middle cerebral artery blood flow investigated with noninvasive transcranial blood velocity measurements. Stroke, 18, 1025-1030, 1987. |
| 13) |
Meck, J.V., Reyes, C.J., Perez, S.A., Goldberger, A.L. and Ziegler, M.G.:Marked exacerbation of orthostatic intolerance after long- vs. short-duration spaceflight in veteran astronauts. Psychosom. Med., 63, 865-873, 2001. |
| 14) |
Newell, D.W., Aaslid, R., Lam, A., Mayberg, T.S. and Winn, H.R.:Comparison of flow and velocity during dynamic autoregulation testing in humans. Stroke, 25, 793-797, 1994. |
| 15) |
Ogawa, Y., Iwasaki, K., Aoki, K., Saitoh, T., Kato, J. and Ogawa, S.:Dynamic cerebral autoregulation after mild dehydration to simulate microgravity effects. Aviat. Space Environ. Med., 80, 443-447, 2009. |
| 16) |
Ogawa, Y., Aoki, K., Kato, J. and Iwasaki, K.:Differential effects of mild central hypovolemia with furosemide administration vs. lower body suction on dynamic cerebral autoregulation. J. Appl. Physiol., 114, 211-216, 2013. |
| 17) |
Poulin, M.J. and Robbins, P.A.:Indexes of flow and cross-sectional area of the middle cerebral artery using doppler ultrasound during hypoxia and hypercapnia in humans. Stroke, 27, 2244-2250, 1996. |
| 18) |
Paulson, O.B., Strandgaard, S. and Edvinsson, L.:Cerebral autoregulation. Cerebrovasc. Brain Metab. Rev., 2, 161-192, 1990. |
| 19) |
Serrador, J.M., Picot, P.A., Rutt, B.K., Shoemaker, J.K. and Bondar, R.L.:MRI measures of middle cerebral artery diameter in conscious humans during simulated orthostasis. Stroke, 31, 1672-1678, 2000. |
| 20) |
Smith, S.M.:Red blood cell and iron metabolism during space flight. Nutrition, 18, 864-866, 2002. |
| 21) |
Zhang, R., Zuckerman, J.H., Giller, C.A. and Levine, B.D.:Transfer function analysis of dynamic cerebral autoregulation in humans. Am. J. Physiol., 274, H233-H241, 1998. |
| 22) |
Zhang, R., Zuckerman, J.H., Iwasaki, K., Wilson, T.E., Crandall, C.G. and Levine, B.D.:Autonomic neural control of dynamic cerebral autoregulation in humans. Circulation, 106, 1814-1820, 2002. |