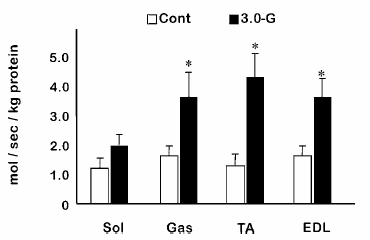
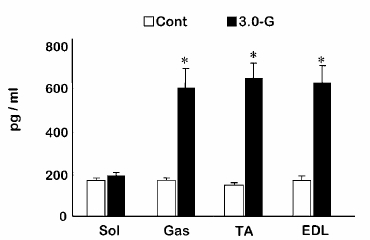
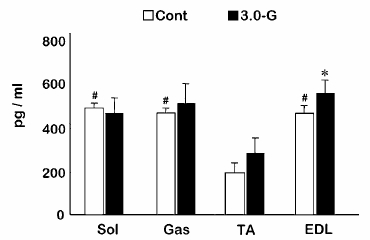
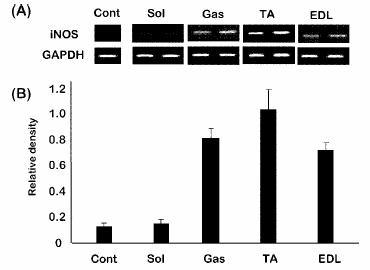
| 1) |
Allen, D.L., Yasui, W., Tanaka, T., Ohira, Y., Nagaoka, S.,
Sekiguchi, C., Hinds, W.E., Roy, R.R. and Edgerton, V.R. :
Myonuclear number and myosin heavy chain expression in
rat soleus single muscle fibers after spaceflight. J. Appl.
Physiol., 81, 145-151, 1996. |
| 2) |
Alonso, M., Collado, P.S. and Gonzalez-Gallego, J. : Melatonin
inhibits the expression of the inducible isoform of
nitric oxide synthase and nuclear factor kappa B activation
in rat skeletal muscle. J. Pineal Res., 41, 8-14, 2006. |
| 3) |
Anderson, J.E. : A role for nitric oxide in muscle repair :
nitric oxide-mediated activation of muscle satellite cells.
Mol. Biol. Cell., 11, 1859-1874, 2000. |
| 4) |
Beck, K.F., Eberhardt, W., Frank, S., Huwiler, A., Messmer,
U.K., Muhl, H. and Pfeilschifter, J. : Inducible NO
synthase : role in cellular signalling. J. Exp. Biol., 202,
645-653, 1999. |
| 5) |
Bozzo, C., Stevens, L., Bouet, V., Montel, V., Picquet, F.,
Falempin, M., Lacour, M. and Mounier, Y. : Hypergravity
from conception to adult stage : effects on contractile
properties and skeletal muscle phenotype. J. Exp. Biol.,
207, 2793-2802, 2004. |
| 6) |
Brickson, S., Hollander, J., Corr, D.T., Ji, L.L. and Best,
T.M. : Oxidant production and immune response after
stretch injury in skeletal muscle. Med. Sci. Sports Exerc.,
33, 2010-2015, 2001. |
| 7) |
Caiozzo, V.J., Haddad, F., Baker, M.J. and Baldwin,
K.M. : Influence of mechanical loading on myosin heavychain
protein and mRNA isoform expression. J. Appl.
Physiol., 80, 1503-1512, 1996. |
| 8) |
Caiozzo, V.J., Haddad, F., Baker, M.J., Herrick, R.E., Prietto,
N. and Baldwin, K.M. : Microgravity-induced transformations
of myosin isoforms and contractile properties of
skeletal muscle. J. Appl. Physiol., 81, 123-132, 1996. |
| 9) |
Chi, M.M., Manchester, J.K. and Lowry, O.H. : Effect of
centrifugation at 2G for 14 days on metabolic enzymes of
the tibialis anterior and soleus muscles. Aviat. Space.
Environ. Med., 69, A9-11, 1998. |
| 10) |
Febbraio, M.A. and Pedersen, B.K. : Muscle-derived
interleukin-6 : mechanisms for activation and possible biological
roles. FASEB J., 16, 1335-1347, 2002. |
| 11) |
Gomez-Cabrera, M.C., Borras, C., Pallardo, F.V., Sastre, J.,
Ji, L.L. and Vina, J. : Decreasing xanthine oxidase-mediated
oxidative stress prevents useful cellular adaptations to
exercise in rats. J. Physiol., 567, 113-120, 2005. |
| 12) |
後藤勝正,大平充宣: 宇宙環境暴露および老化による骨格筋の萎縮,宇宙航空環境医学,44, 49-58, 2007. |
| 13) |
Goto, K., Okuyama, R., Honda, M., Uchida, H., Akema, T.,
Ohira, Y. and Yoshioka, T. : Profiles of connectin( titin) in
atrophied soleus muscle induced by unloading of rats. J.
Appl. Physiol., 94, 897-902, 2003. |
| 14) |
Heinrich, P.C., Castell, J.V. and Andus, T. : Interleukin-6
and the acute phase response. Biochem. J., 265, 621-636,
1990. |
| 15) |
Kawamura, T., Yoshida, K., Sugawara, A., Nagasaka, M.,
Mori, N., Takeuchi, K. and Kohzuki, M. : Impact of exercise
and angiotensin converting enzyme inhibition on
tumor necrosis factor-alpha and leptin in fructose-fed
hypertensive rats. Hypertens. Res., 25, 919-926, 2002. |
| 16) |
Kita, S., Iwasaki, K., Onishi, R., Fujisawa, M., Kim, H.,
Shibata, S. and Ito, M. : Bone metabolism and formation of
mice bred in a 2G environment. Adv. Space. Res., 32,
1453-1457, 2003. |
| 17) |
Kita, S., Shibata, S., Kim, H., Otsubo, A., Ito, M. and Iwasaki,
K. : Dose-dependent effects of hypergravity on body
mass in mature rats. Aviat. Space. Environ. Med., 77,
842-845, 2006. |
| 18) |
Kobzik, L., Stringer, B., Balligand, J.L., Reid, M.B. and
Stamler, J.S. : Endothelial type nitric oxide synthase in
skeletal muscle fibers : mitochondrial relationships. Biochem.
Biophys. Res. Commun., 211, 375-381, 1995. |
| 19) |
Koskinen, S.O., Wang, W., Ahtikoski, A.M., Kjaer, M., Han,
X.Y., Komulainen, J., Kovanen, V. and Takala, T.E. : Acute
exercise induced changes in rat skeletal muscle mRNAs
and proteins regulating type IV collagen content. Am. J.
Physiol. Regul. Integr. Comp. Physiol., 280, R1292-1300,
2001. |
| 20) |
Langberg, H., Olesen, J.L., Gemmer, C. and Kjaer,
M. : Substantial elevation of interleukin-6 concentration in
peritendinous tissue, in contrast to muscle, following prolonged
exercise in humans. J. Physiol., 542, 985-990,
2002. |
| 21) |
Moncada, S. and Higgs, E.A. : Molecular mechanisms and
therapeutic strategies related to nitric oxide. FASEB J.,
13, 1319-1330, 1995. |
| 22) |
Nathan, C. and Xie, Q.W. : Nitric oxide synthases : roles,
tolls, and controls. Cell, 78, 915-918, 1994. |
| 23) |
Ohira, Y., Yoshinaga, T., Ohara, M., Nonaka, I., Yoshioka, T.,
Yamashita-Goto, K., Shenkman, B.S., Kozlovskaya, I.B.,
Roy, R.R. and Edgerton, V.R. : Myonuclear domain and
myosin phenotype in human soleus after bed rest with or
without loading. J. Appl. Physiol., 87, 1776-1785, 1999. |
| 24) |
Ohira, Y., Yoshinaga, T., Nomura, T., Kawano, F., Ishihara,
A., Nonaka, I., Roy, R.R. and Edgerton, V.R. : Gravitational
unloading effects on muscle fiber size, phenotype and myonuclear
number. Adv. Space. Res., 30, 777-781, 2002. |
| 25) |
Ostrowski, K., Rohde, T., Zacho, M., Asp, S. and Pedersen,
B.K. : Evidence that interleukin-6 is produced in human
skeletal muscle during prolonged running. J. Physiol.,
508, 949-953, 1998. |
| 26) |
Pecaut, M.J., Miller, G.M., Nelson, G.A. and Gridley,
D.S. : Hypergravity-induced immunomodulation in a
rodent model : hematological and lymphocyte function
analyses. J. Appl. Physiol., 97, 29-38, 2004. |
| 27) |
Picquet, F., Bouet, V., Cochon, L., Lacour, M. and Falempin,
M. : Changes in rat soleus muscle phenotype consecutive
to a growth in hypergravity followed by normogravity.
Am. J. Physiol. Regul. Integr. Comp. Physiol., 289, R217-224, 2005. |
| 28) |
Riley, D.A., Ellis, S., Slocum, G.R., Sedlak, F.R., Bain, J.L.,
Krippendorf, B.B., Lehman, C.T., Macias, M.Y., Thompson,
J.L., Vijayan, K. and De Bruin, J.A. : In-flight and postflight
changes in skeletal muscles of SLS-1 and SLS-2
spaceflown rats. J. Appl. Physiol., 81, 133-144, 1996. |
| 29) |
Rosendal, L., Sogaard, K., Kjaer, M., Sjogaard, G., Langberg,
H. and Kristiansen, J. : Increase in interstitial interleukin-
6 of human skeletal muscle with repetitive lowforce
exercise. J. Appl. Physiol., 98, 477-481, 2005. |
| 30) |
Sakurai, T., Hollander, J., Brickson, S.L., Ohno, H., Ji, LL.,
Izawa, T. and Best, T.M. : Changes in nitric oxide and
inducible nitric oxide synthase following stretch-induced
injury to the tibialis anterior muscle of rabbit. Jpn. J.
Physiol., 55, 101-107, 2005. |
| 31) |
Salminen, A. and Kihlstrom, M. : Protective effect of indomethacin
against exercise-induced injuries in mouse skeletal
muscle fibers. Int. J. Sports Med., 8, 46-49, 1987. |
| 32) |
Salminen, A. : Lysosomal changes in skeletal muscles during
the repair of exercise injuries in muscle fibers. Acta.
Physiol. Scand. Suppl., 539, 1-31, 1985. |
| 33) |
Shibata, S., Kita, S., Kim, H., Ito, M. and Iwasaki, K. : Morphometric
changes in vagal nerves of fourth generation
mice passage-bred in a 2-G environment. Aviat. Space.
Environ. Med., 75, 387-390, 2004. |
| 34) |
Stowe, R.P., Yetman, D.L., Storm, W.F., Sams, C.F. and
Pierson, D.L. : Neuroendocrine and immune responses to
16-day bed rest with realistic launch and landing G profiles.
Aviat. Space. Environ. Med., 79, 117-122, 2008. |
| 35) |
Tidball, J.G., Lavergne, E., Lau, K.S., Spencer, M.J., Stull,
J.T. and Wehling, M. : Mechanical loading regulates NOS
expression and activity in developing and adult skeletal
muscle. Am. J. Physiol. Cell. Physiol., 275, C260-266,
1998. |
| 36) |
Torres, S.H., De Sanctis, J.B., de L. Briceno, M., Hernandez,
N. and Finol, H.J. : Inflammation and nitric oxide production
in skeletal muscle of type 2 diabetic patients. J.
Endocrinol., 181, 419-427, 2004. |
| 37) |
Wang, X.D., Kawano, F., Matsuoka, Y., Fukunaga, K.,
Terada, M., Sudoh, M., Ishihara, A. and Ohira,
Y. : Mechanical load-dependent regulation of satellite cell
and fiber size in rat soleus muscle. Am. J. Physiol. Cell.
Physiol., 290, C981-989, 2006. |
| 38) |
Widrick, J.J., Knuth, S.T., Norenberg, K.M., Romatowski,
J.G., Bain, J.L., Riley, D.A., Karhanek, M., Trappe, S.W.,
Trappe, T.A., Costill, D.L. and Fitts, R.H. : Effect of a 17
day spaceflight on contractile properties of human soleus
muscle fibres. J. Physiol., 516, 915-930, 1999. |
| 39) |
Yang, Y., Baker, M., Graf, S., Larson, J. and Caiozzo,
VJ. : Hypergravity resistance exercise : the use of artificial
gravity as potential countermeasure to microgravity. J.
Appl. Physiol., 103, 1879-1887, 2007. |