宇宙航空環境医学 Vol. 44, No. 2, 49-58, 2007
総説
宇宙環境暴露および老化による骨格筋の萎縮
後藤 勝正1,大平 充宣2
1豊橋創造大学リハビリテーション学部
2大阪大学大学院医学系研究科
Muscle Atrophy Induced by the Exposure to Microgravity Environment and/or Aging
Katsumasa Goto1,Yoshinobu Ohira2
1Laboratory of Physiology, Toyohashi SOZO University
2Graduate School of Medicine, Osaka University
ABSTRACT
Atrophy of skeletal muscle is induced in response to gravitational unloading
caused by exposure to microgravity environment. Development of a countermeasure
for prevention of muscle atrophy is an essential requirement for long-duration
space flight using, for example, the International Space Station. Numerous studies
have been performed to develop the countermeasures. However, effective countermeasures
are not necessarily established yet, because the molecular mechanisms responsible
for muscle hypertrophy and atrophy are still unclear. On the other hand, aging
also causes a decrease of skeletal muscle mass and force generation. It is unclear
that the pathological characteristics of aging-related muscle atrophy are the
same as those of unloading-related muscle atrophy. The molecular mechanisms for
aging-related muscle atrophy are not established, either. Maintenance of skeletal
muscle mass is considered to be dependent on the dynamic balance between the
synthesis and the degradation of muscle proteins. Degradation of skeletal muscle
proteins are regulated by the intracellular systems, such as calpain, cathepsin,
and/or ubiquitin-proteasome. Recently, it has been suggested that satellite cells,
located under the basal lamina of skeletal muscle cell, play an important role
in muscle hypertrophy. Several studies show that the mechanical stretch, which
would induce muscle hypertrophy, results in an elevated satellite cell number.
However, molecular mechanisms responsible for exercise- and/or stretch-induced
muscle hypertrophy are still unclear. We propose that heat stress, which activate
the satellite cells, might be a useful tool for prevention of muscle atrophy
caused by space flight and/or aging, and that it could be applied for rehabilitation
and/or athletic training.
(Received: 24 March, 2007 Accepted: 27 April, 2007)
Key words: 骨格筋,萎縮,無重量環境,老化,カウンターメジャー
はじめに
宇宙滞在による無重量環境暴露は,骨格筋の萎縮を招く。この骨格筋の萎縮は,単に形態的なatrophyにとどまらず,筋力低下をはじめさまざまな収縮機能の退行性変化を伴うことが明らかになっている。無重量環境暴露による骨格筋の萎縮は,主に骨格筋に対する荷重が除去されることが原因であると考えられ,比較的短期間で顕著な筋萎縮が認められる。このタイプの骨格筋萎縮のことを廃用性筋萎縮と呼び,ベッドレストやギプス固定などの結果としても生じる萎縮と同じ病態を示す。似たような骨格筋の萎縮は,老化現象の一つとしても知られている。老化に伴う退行性変化として起こる骨格筋の萎縮は,加齢性筋肉減弱症(サルコペニア)と呼ばれる。サルコペニアとしての骨格筋の萎縮は,無重量環境暴露などによる廃用性筋萎縮とは原因が異なることが予想されているものの,その原因は未だ不明な点が多い。廃用性筋萎縮が比較的短期間で引き起こされるのに対して,サルコペニアとしての筋萎縮は加齢と共にゆっくりと進行するという違いは明確である。
骨格筋の萎縮とは,一般的に筋組織に含まれる一本一本の筋線維の萎縮や筋線維数の減少によるものである。こうした現象自体に廃用性筋萎縮とサルコペニアとして骨格筋萎縮に差異はない。しかし,筋萎縮を引き起こす原因が異なることは,萎縮を招く分子機構や萎縮の病態にも差異があると考えられる。これまで萎縮筋における細胞の変性,壊死や崩壊などの病態12,28,41)が数多く報告されているものの,筋萎縮のメカニズムについては両者共に未だ不明な点が多く残されている。
さて,日本が独自に開発した宇宙実験施設「きぼう」の打ち上げと国際宇宙ステーションへの組込み作業が目前となり,日本でも宇宙環境を利用した様々な生命科学系の実験が計画されている。1-Gの重力環境下では得られない知見を無重量環境はもたらしてくれるであろうと期待されている。そして,地球上での我々の生活にそうした知見が還元される日もそれほど遠いものではないと思われる。骨格筋に関する研究においても,宇宙環境での実験には大きな期待が寄せられているのはいうまでもない。また,日本人宇宙飛行士を含めたより多くの宇宙飛行士が無重量環境の宇宙空間に長期間滞在することになり,骨格筋萎縮のカウンターメジャーの開発は早期に行う必要がある重要な課題である。骨格筋は関節を固定したり動かしたりすることで「動作」を発現するだけでなく,我々の身体の骨格を構築するもう1つの要素である骨に張力を与えて,骨形成を刺激する因子として重要である。骨格筋は生体内で一定の緊張状態にあるので,骨格筋量を維持することだけで骨萎縮のカウンターメジャーとなる。さらに,骨格筋量に応じて毛細血管網も形成・維持されるので,骨格筋萎縮のカウンターメジャーは体液量の保持にも有効であり,循環系のディコンディショニングのカウンターメジャーの1つになり得る。さらには,インスリン感受性の低下は,骨格筋量の増大により改善が可能である。したがって,骨格筋萎縮のカウンターメジャーの開発は,単に骨格筋萎縮の予防だけでなく,様々な生体機能の退行性変化のカウンターメジャーにつながることが期待されている。
そこで本稿では,骨格筋萎縮のメカニズムを見つめ直し,骨格筋萎縮のカウンターメジャーの開発について再考すると共に,無重量環境暴露などによる廃用性筋萎縮とサルコペニアによる骨格筋萎縮の病態を比較することで,宇宙実験で得られる成果の地上生活への活用について再検討することを目的とする。骨格筋の萎縮は,筋ジストロフィー症などに代表される神経筋疾患でも認められるが,このタイプの筋萎縮については,別の機会に概説したい。
骨格筋の萎縮
一般に細胞の形態は,構造タンパク質の合成(再生)と分解(崩壊)の動的な平衡により決定されると考えられている。個体の成長が終わり成熟期に入ると,骨格筋細胞などの大きさはほぼ一定に維持されているが,これはタンパク質の合成と分解が平衡状態にあることによる。例えば何らかの原因により,前者が亢進すると成長を含めた骨格筋肥大や過形成が生じ,後者の場合は筋萎縮が起こる。タンパク質の合成と分解は共に,インスリン様成長因子(insulin-like
growth factor-I: IGF-I)や甲状腺ホルモンなどにより調節されている。しかし,前述したように骨格筋は無重量環境などのようなある特定の状態に置かれると,細胞骨格や収縮タンパク質の分解が亢進し,合成が抑制されて筋萎縮が生じる。構造タンパク質の崩壊は,筋原線維の縮小,太いフィラメントや細いフィラメントの分解,細胞内小器官であるミトコンドリアや筋小胞体の消失を伴い,筋線維数の減少,筋線維の縮小,線維化を生じて,結果として組織としての筋萎縮の状態を呈する。しかし,こうした病態を引き起こす筋萎縮の分子機構には不明な点が多く残されており,それらの全容は未だ明らかになっていない。
筋萎縮には,細胞内タンパク質の分解が亢進していることは言うまでもない。これまで明らかになっている筋細胞内に存在するタンパク質の分解系は,リソソーム系,Ca2+
依存性タンパク分解(カルパイン)系およびユビキチン−プロテアソーム系がある。
1) リソソーム系
リソソームは細胞内小器官の一つで,細胞内の不要になったタンパク質の分解系として機能していることはよく知られている。カテプシンはリソソームに含まれるタンパク分解酵素の総称であり,細胞内タンパク分解酵素としては古くから知られている。このカテプシンの基質として,ミオシン重鎖,トロポニンT,トロポニンI,トロポミオシンをはじめ,アルドラーゼや乳酸脱水素酵素など細胞質の多くのタンパク質が挙げられる。骨格筋の萎縮に伴い,カテプシンBおよびDが増加する。骨格筋萎縮をもたらす2つの異なる実験モデルである除神経とラットの後肢懸垂モデルでは,筋萎縮をもたらすタンパク分解系の亢進レベルに差があり,除神経の方がより早期に萎縮が生じることが知られている。除神経による筋萎縮はリソソーム系を阻害すると抑制されることから,除神経後の早期に認められるタンパク分解亢進は主にリソソーム系によるものである。一方,後肢懸垂および除神経でも比較的ゆっくりとしたタンパク分解は,後述するカルパイン系とユビキチン−プロテアソーム系によると考えられている。このことは,カテプシンの活性化は,神経系の影響を大きく受けることも示唆している。神経筋疾患などでは,除神経の場合と同様にリソソーム系が筋タンパク質の分解の主役を演じている。さらに,Ca2+
もカテプシンの活性化に関与していることも分かっている39)。したがって,筋形質膜の損傷など筋細胞内Ca2+ 濃度維持機構の破綻は,細胞内Ca2+ の上昇を招いてリソソーム系のタンパク質分解を活性化させ,さらには後述するカルパイン(calcium
activated neutral protease: CANP)系の活性化を引き起こす。
2) Ca2+ 依存性タンパク分解(カルパイン)系
細胞内Ca2+濃度の上昇は,筋細胞構造タンパクの分解を引き起こす1つの大きな要因である。一方で,筋細胞内のCa2+ は,骨格筋の興奮収縮連関において重要な働きを演じている。静止状態の筋細胞内外のイオン環境は,細胞膜を境にしてNa+,K+,Cl−
と共にCa2+ の濃度に大きな違いがある。つまり,Na+,Cl− およびCa2+ 濃度は細胞外で高く,K+ は細胞内の方が高濃度である。このイオン環境の細胞内外の差を利用して,筋細胞は活動性(興奮性)を得ている。例えば,筋細胞を含めた興奮性の細胞では,Na+
が細胞内に急速に流入することで活動電位を発生し,刺激応答反応という一種の情報伝達系として機能している。さらにCa2+ は,細胞内濃度が10−7 Mと非常に低く,細胞外からのCa2+
流入あるいは細胞内のCa2+ ストア(小胞体)からの細胞質への放出を行うことで,細胞内の情報伝達系として機能している。骨格筋では,筋細胞膜の電気的な興奮に引き続き起こるCa2+
ストアである筋小胞体からのCa2+放出が,細いフィラメントと太いフィラメントの相互作用すなわち力発生のトリガーとなっている。このような収縮情報の細胞内情報伝としての機能をCa2+
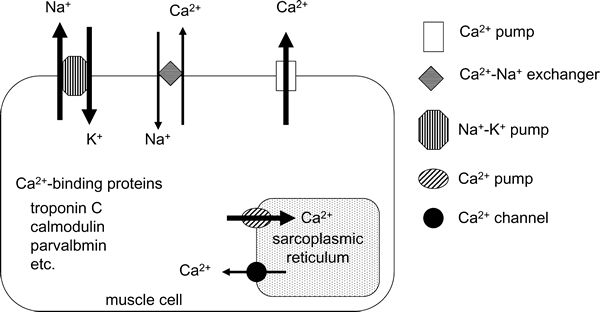
に持たせるために,細胞内Ca2+ 濃度が静止時には様々な仕組みにより低く抑えられている(図1)。ミトコンドリアもCa2+取り込み能を持つことが知られている44)。
 |
|
| Fig. 1. | Systems for the regulation of Ca2+ concentration in skeletal muscle cells. In the resting state, the intracellular Ca2+ concentration is maintained at a lower level compared with the extracellular space. The lower level of intracellular Ca2+ concentration is due to 1) Ca2+- and Na+-K+ pumps, 2) Na+-Ca2+ exchanger, 3) Ca2+-pump in sarcoplasmic reticulum, and 4) Ca2+-binding proteins, such as calmodulin, parvalbmin, and/or troponin C. Bold arrows show the ATP-dependent transportation. |
こうした筋収縮の興奮収縮連関において重要な働きを担っているCa2+が,条件によってはある種のタンパク分解酵素を活性化する。Ca2+ によって活性化される酵素はカルパインであり,至適pHはカテプシンが酸性であるのに対して中性付近となっている。太いフィラメントを構成するミオシンやトロポニンおよびα-アクチニンおよび細胞骨格蛋白質であるビメンチンなどがカルパインの基質として知られる。カルパインには1
mM程度のCa2+ で活性化されるカルパインⅡ(mCANP)と10 μM程度のCa2+ により活性化させるカルパインⅠ(μCANP)の2種類に分類される6,9)。前述したように筋細胞内の生理的なCa2+
濃度は1.0 μM以下であり,カルパインⅠが活性化するにも極めて低い濃度である。すなわち,細胞膜の破壊や筋小胞体のCa2+ 取り込み機能あるいは細胞外へのCa2+
排出機構の破綻が生じない限り,生理的な条件下ではカルパイン系が活性化することはないとされる18)。しかし,無重量環境への暴露,ギプス固定や除神経により引き起こされる筋萎縮に伴い,カルパインが活性化する。これは,細胞内Ca2+
濃度調節の破綻による細胞内Ca2+ の増加あるいは細胞内Ca2+ 緩衝タンパク質であるパルブアルブミンなどの減少によると考えられる40)。しかし,後肢懸垂による静止状態の細胞内Ca2+
濃度の増加は,せいぜい30〜40%程度である7)ことから,他の活性化機構の存在が示唆される。
3) ユビキチン−プロテアソーム系
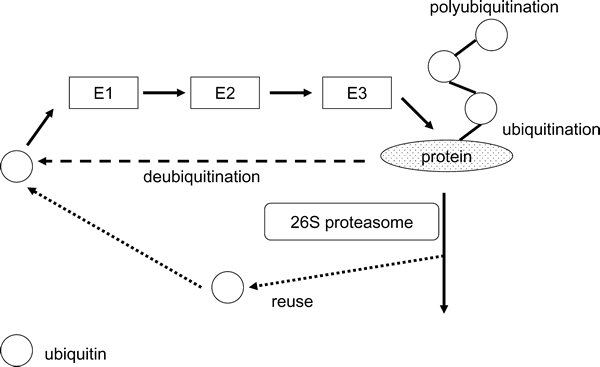
ユビキチンは,76のアミノ酸から構成される分子量約8,600のタンパク質で,真核生物に広く分布する。ユビキチンによるタンパク分解43) は,まずユビキチン活性化酵素(E1)がATPエネルギーを利用してユビキチンを活性化することに始まる。次に,ユビキチン結合酵素(E2)へユビキチンが転移され,さらにユビキチンはユビキチンリガーゼ(E3)へ転移される。その後,基質となるタンパク質にユビキチンが結合する。これをユビキチン化と呼ぶ。この時E3は,ユビキチンと結合することなく,単に基質を認識する分子として働く場合もある。ユビキチン化したタンパク質では,さらにユビキチン分子に対するユビキチン化が起こり,マルチユビキチン鎖が形成されていく。26Sプロテアソームは,このマルチユビキチン鎖を認識して,基質タンパク質をATP依存的に分解する(図2)。また,ユビキチンは26Sプロテアソーム中に存在する脱ユビキチン化酵素により遊離されて,再利用される。この脱ユビキチン化酵素はユビキチン化反応を可逆的にすることで,記憶(長期増強),形態形成,細胞増殖,DNA合成,ウィルス感染,染色体の構造維持など多くの生命現象を制御していると考えられている43)。タンパク質分解系としてのユビキチン−プロテアソーム系の機能は,細胞周期関連因子,癌遺伝子産物,癌抑制遺伝子産物,転写因子,シグナル伝達分子など寿命の短いタンパク質やダメージを受けた異常タンパク質を分解することである。また,分解タンパク質の認識はE3によるものであると考えられている43)。
 |
|
| Fig. 2. | Ubiquitin-proteasome system. |
ユビキチン−プロテアソーム系は,熱,紫外線,重金属や放射線などの外界からの化学的ストレスや虚血,ウィルス感染,アシドーシス,飢餓などの生理的ストレスにより活性化される19)。細胞内にはストレスに対する2つの防御系を備えている。1つは,障害を受けたタンパク質の修復およびその処理であり,もう1つはストレス環境への適応を含めたストレス受容の抑制である。HSP70などに代表されるheat
shock protein(stress protein)は,ストレス環境下で傷害されたタンパク質の修復に関与している。しかし,修復不可能なタンパク質は速やかに分解される。実際ユビキチン遺伝子には,リボゾームのサブユニットに連結したものとユビキチン遺伝子が直列に連結したものがあり,後者は熱ショックで誘導される。
最近の研究により筋萎縮機構においてユビキチン−プロテアソーム系は重要な役割を演じていることが明らかにされている35,36)。例えば,除神経による筋萎縮の場合,リソソーム系とカルパイン系のタンパク分解反応を阻害しても萎縮を抑制することはできないが,ユビキチン−プロテアソーム系を阻害すると筋萎縮が大幅に軽減される9)。また,グルココルチコイドも骨格筋のタンパク質分解を亢進させることが知られているが,これはカルパイン系とユビキチン−プロテアソーム系の両方が活性化するためである。加齢に伴う筋萎縮においても,このグルココルチコイド依存性のユビキチン−プロテアソーム系が関与している2,5)。さらに,低インスリン状態もユビキチン−プロテアソーム系を活性化することが知られている25)。したがって,筋萎縮においてユビキチン−プロテアソーム系が重要な役割を演じているのは間違いない35,36)。
筋萎縮時には筋特異的ユビキチンリガーゼであるMuRF-1(muscle RING Finger-1)およびatrogin-1(MAFbx: muscle
atrophy factor box)が活性化する3)。これらの発現を抑制することで,筋萎縮はまた抑制される3)。MuRF-1やatrogin-1の発現は,脱リン酸化型のforkhead
transcription factorであるFOXOが核内に留まることによる32)。FOXOのリン酸化はAktによると考えられており,FOXOはリン酸化されると核外へ排出される。一方,インスリンやIGF-1などの刺激によるAktの活性化が骨格筋量の維持に重要であると考えられていたが,この作用の1つはタンパク分解抑制であると考えられる。最近,PCG-1α(peroxisome
proliferator-activated receptor gamma coactivator 1 alpha)もFOXOに依存した筋萎縮に関与していることが指摘されている33)。つまり,FOXOの脱リン酸化を促進するかあるいはMuRF-1やatrogin-1を阻害することができれば筋萎縮を抑制できると考えられるようになった。しかし,FOXOは増殖を妨げる遺伝子の発現を活性化させてアポトーシスを助長する。したがって,FOXOの脱リン酸化を無秩序に助長すると発癌につながる可能性がある。FOXOのリン酸化はAktだけでなくIBキナーゼ(IKK)も関与しており,FOXOの細胞内局在調節には発癌や腫瘍形成の分野でも着目されている18)。
廃用性筋萎縮
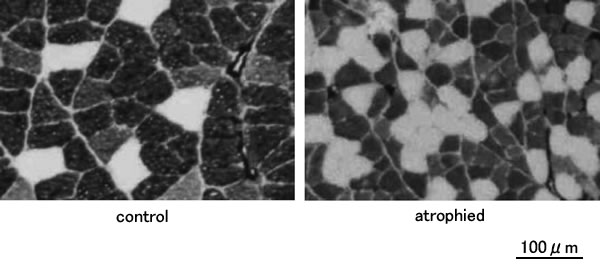
宇宙滞在による無重量環境への暴露あるいは長期のベッドレストやギプス固定などによる運動制限や活動量減少に起因した萎縮を廃用性筋萎縮と呼ぶ。速筋化を伴った筋線維の萎縮(図3)とそれに伴う筋力低下が特徴である。地球上では,ヒラメ筋や脊柱起立筋群などの骨格筋は重力に抗した活動が求められる。しかし,軌道上のスペースシャトルや国際宇宙ステーション内部では,重力の影響は少ない(微小重力環境)上に,遠心力と微小重力が均衡しているので,見かけ上無重量環境となっている。したがって,ヒトが活動し得る宇宙空間では重量が消失し,その結果として抗重力筋本来の活動が不要となる。この抗重力筋活動の抑制が廃用性萎縮の大きな原因と考えられ,抗重力筋に顕著な萎縮が認められる。
 |
|
| Fig. 3. | Images of the frozen cross-section of soleus muscles stained by Actomyosin ATPase (pH 4.35). Dark and light fibers are slow-twitch and fast-twitch fibers, respectively. Following skeletal muscle atrophy, the cross-sectional area of muscle fibers and the relative proportion of slow-twitch fibers are decreased and the proportion of fast-twitch fibers is increased. |
廃用性萎縮のメカニズムについては依然として不明な点が多く残されている。抗重力筋活動の抑制により,筋の電気的活動(筋電図)は即座に減少するが,次第に回復してくる1,21,30)。しかし,筋萎縮は進行することから29,37),このような現象は必ずしも
“不活動”によるものではない。例えば,筋の受動的な短縮により張力発揮が減少するとともに,感覚神経活動が抑制されることが萎縮の原因であるとも報告されている21)。筋衛星細胞数の減少または機能低下も重要な因子であるという知見もある20)。速筋化は張力発揮抑制によるATP
turnover rateの鈍化に起因している29)。
廃用性筋萎縮では,まずタンパク質合成の抑制が起こり,その後蛋白質の分解が亢進すると考えられている45)。萎縮初期における蛋白質合成の抑制は,翻訳の減少による23)。さらにこの翻訳の減少は,タンパク質合成過程におけるポリペプチド鎖延長反応の遅延化による23)。筋萎縮には,細胞内におけるタンパク質分解の亢進が関与していることは言うまでもない。筋細胞内に存在するタンパク質の分解系には,リソソーム系,Ca2+
依存性タンパク質分解(カルパイン)系およびユビキチン−プロテアソーム系が複雑に関与し,筋萎縮が生じるものと思われる。廃用性筋萎縮は単に筋細胞の退行性変化にとどまらず,廃用性萎縮に伴い脊髄前角のα運動神経細胞にも変化が生じることも報告されている。この末梢神経系の変容も筋力低下の1つの要因であることは言うまでもない。
サルコペニア
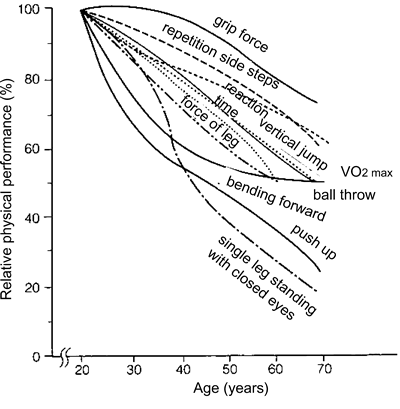
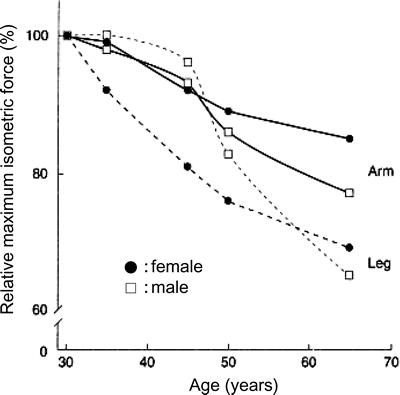
サルコペニアの特徴としては,筋萎縮だけでなく,筋力や筋持久力などの機能的低下を挙げることができる(図4)34)。骨格筋のパフォーマンス(筋力,収縮速度,パワー,疲労耐性など)は,20〜30歳代にピークを迎える。その後,徐々に低下し,60歳を越える頃には20〜30歳代の値の約60% にまで低下する22)。60歳以降に見られる筋力の低下は,女性に比べて男性で顕著である(図5)27)。また,上肢に比べて下肢の筋力低下が著しい。廃用性萎縮が数週間という比較的短期間で招来されるのに対して,サルコペニアは加齢減少として出現するのできわめてゆっくりと進行するのが特徴である。
 |
|
| Fig. 4. | Changes in physical performance in response to aging. (modified from Ref. 34) |
 |
|
| Fig. 5. | Changes in the maximum isometric force in response to aging. ●−●: upper arm of females, ●‥●: legs of females, □−□: upper arm of male, □‥□: legs of males. (modified from Ref. 27) |
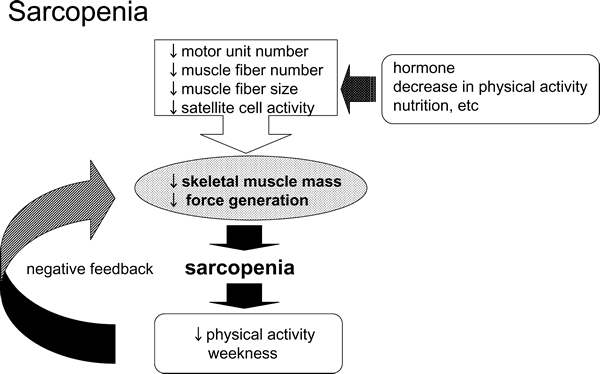
サルコペニアには,様々な要素が関係していることが予想されている(図6)。まず,運動単位(脊髄前角に存在する一つのα運動神経細胞とそれに支配される筋細胞)の変化である7,8,16)。一つのα運動神経細胞が支配する筋線維数には大きな違いがあり,一般に指先などの細かい正確な動きに関与する筋肉では神経支配比が小さく,大腿部などの大きな動きに関与する筋肉では逆に運神経支配比は大きい。高齢者では,同じ筋力レベルを発揮する際に,若齢者に比べて大きな運動単位が動員される27)。したがって,中枢からの筋収縮情報自体が,高齢者と若齢者では異なると考えられる。さらに,高齢者における筋力低下の一因として,筋収縮に関与する運動単位数の減少も挙げられる。
 |
|
| Fig. 6 | Sarcopenia. Decrease in force generation and skeletal muscle mass in response to aging. |
サルコペニアの典型的な特徴の一つである筋萎縮は,筋線維数の減少と個々の筋線維の萎縮による27)。筋力は収縮に関与する筋細胞の横断面積の総和に依存することから,筋肉量の減少も老化に伴う筋力低下の原因である。すなわち,収縮に関与する運動単位の変化と筋萎縮が高齢者における筋力低下を引き起こすものと考えられる。
また,筋力は筋線維の興奮収縮連関の結果として生じるが,この興奮収縮連関に関わる要素にも加齢に伴う退行性変化が認められる。骨格筋細胞の膜電位自体は加齢の影響を受けないが,①
膜抵抗の増加,② 活動電位発生の閾値低下,③ 活動電位の縮小,④ 再分極の遅延など,膜の諸性質に変化が見られる11)。筋細胞膜の諸性質の変調は,膜の興奮性を低下させて力発生の抑制や疲労耐性の低下を引き起こすと考えられる。これは,老化に伴う成長因子の分泌低下と関連があることが示唆されている6)。また,加齢により横行小管膜のジハイドロピリジン受容体と筋小胞体膜のリアノジン受容体の発現量が減少して,両者間のシグナル伝達が不良状態に陥ることも,筋力低下の原因となる31)。また,摂取カロリーを制限することにより両受容体の発現量は増加し,単収縮力や拘縮張力も増加するので24),栄養レベルの変化により何らかの調節を受けている可能性もあろう。また,筋線維膜の興奮性の変化やそれに関わるイオンチャンネルおよびNa+-K+
ポンプも,加齢に伴って変化することが知られている11)。
加齢に伴う現象として,筋線維の収縮速度の低下も挙げることができる25)。これは,速筋線維にも遅筋線維にも認められる現象である。速筋線維における収縮速度低下の一因として,筋小胞体の含有量と筋小胞体Ca2+
ポンプ機能の低下25) が関与している。一方,遅筋線維における加齢に伴う収縮速度の低下は,ミオシン分子やトロポニンCの変化などに起因すると考えられている10)。また,速筋線維数の減少や選択的萎縮も骨格筋における加齢性変化として知られている27)。
骨格筋萎縮に対する予防策(カウンターメジャー)
骨格筋は可塑性に富んだ器官であり,当然筋萎縮の防止は可能である。しかし,宇宙飛行やベッドレスト中などはメカニカルな負荷をかける抗重力活動等が不可能であるために萎縮が誘発される。したがって,萎縮予防策の解明は,宇宙医学等の分野では大きな研究テーマでもある。バンジーコードを使って身体を引き付けながらのトレッドミル歩行や自転車エルゴメーター運動などはすでに活用されているが,筋の受動的ストレッチの有効性も確認されている28,41)。
骨格筋の肥大には,筋線維内におけるタンパク質合成の促進および筋衛星細胞の融合により筋組織を構成する個々の筋線維の肥大と新たな筋線維の形成が関与している。筋衛星細胞の増殖能力を高め,筋線維への融合あるいは新たな筋線維の形成を促進させることが筋肥大をもたらすのではないかと考えられている。成長ホルモンやインスリン,テストステロンなどの内分泌系や神経系因子,さらに各種成長因子やメカニカルなストレスは,筋衛星細胞の活性化を引き起こす17)。逆に,サルコペニアは老化に伴う筋衛星細胞の活性化因子の減少とも関係している4)。しかし,筋衛星細胞とその活性化因子が残存している限り,筋肥大はいかなる年代でも可能であろう。従って,各種の運動が処方されているが,筋力トレーニングは血圧上昇などを招く恐れがあり,高齢者にはリスクが大きい。
そこで,著者らは高齢者向けのカウンターメジャーとして,上述したストレッチ等28,41) に加えて温熱刺激を活用した方法を提案している。これまで,1) 予め温熱刺激を与えてからトレーニングすると筋肥大が促進すること,2) 温熱刺激のみで筋肥大が引き起こされること,3) 廃用性萎縮からの回復は温熱刺激により促進することなど13,14,37,42) を確認した。さらに,ヒトを対象に実験を行い,温熱負荷と30RM未満の軽運動を組み合わせることで上腕二頭筋の筋横断面積の増大(筋肥大)と等尺性最大肘屈曲力の増加が起こることを異なる方法で複数回証明した15)。この実験で用いた運動は極めて軽い運動であり,回数も1セット当たり30回の屈曲伸展運動とし,それを1日に3セット,週4回実施したのみである。また,温熱負荷も1日に1時間とし,週に4日とした。温熱負荷中に肘の運動を行っている。したがって,運動時間は数分であり,温熱負荷のみの時間は行動制限はないことから,骨格筋萎縮のカウンターメジャーとして有用であると考えている。
おわりに
無重量環境暴露による廃用性筋萎縮のメカニズムと病態について,老化によるサルコペニアとの比較を含めて概説した。誌面の制約上,もちろん全ての病態と予防策について説明できたわけではなく,本稿で触れていないエビデンスも多数ある。骨格筋の萎縮には筋衛星細胞をはじめとする体性幹細胞が重要な役割を演じており,今後こうした細胞群に関しての研究が進むことにより骨格筋量と筋機能の制御が可能となり,宇宙飛行士のQOLの向上さらにはサルコペニアの予防が近い将来可能となることに期待したい。
謝辞
本総説に関する研究の一部は,基盤研究C(17500444,KG),A(18200042,TY),S(19100009,YO),萌芽研究(18650188,YO)および財団法人日本宇宙フォーラム公募地上研究(KG)により実施されたものであります。ここに,謝意を表します。
参考文献
| 1) | Alford, E.K., Roy, R.R., Hodgson, J.A. and Edgerton, V.R.: Electromyography of rat soleus, medial gastrocnemius, and tibialis anterior during hind limb suspension. Exp. Neurol., 96, 635-649, 1987. |
| 2) | Bardag-Gorce, F., Farout, L., Veyrat-Durebex, C., Briand, Y. and Briand, M.: Changes in 20S proteasome activity during ageing of the LOU rat. Mol. Biol. Rep., 26, 89-93, 1999. |
| 3) | Bodine, S.C., Latres, E., Baumhueter, S., Lai, V.K., Nunez, L., Clarke, B.A., Poueymirou, W.T., Panaro, F.J., Na, E., Dharmarajan, K., Pan, Z.Q., Valenzuela, D.M., Dechiara, T.M., Stitt, T.N., Yancopoulos, G.D. and Glass, D.J.: Identification of ubiquitin ligases required for skeletal muscle atrophy. Science, 294, 1704-1708, 2001. |
| 4) | Conboy, I.M., Conboy, M.J., Wagers, A.J., Girma, E.R., Weissman, I.L. and Rando, T.A.: Rejuvenation of aged progenitor cells by exposure to a young systemic environment. Nature, 433, 760-764, 2005. |
| 5) | Dardevet, D., Sornet, C., Taillandier, D., Savary, I., Attaix, D. and Grizard, J.: Sensitivity and protein turnover response to glucocorticoids are different in skeletal muscle from adult and old rats. Lack of ergulation of the ubiquitin-proteasome proteolytic pathway in aging. J. Clin. Invest., 96, 2113-2119, 1995. |
| 6) | De Luca, A., Pierno, S., Cocchi, D. and Conte Camerino, D.: Effects of chronic growth hormone treatment in aged rats on the biophysical and pharmacological properties of skeletal muscle chloride channels. Br. J. Pharmacol., 121, 369-374, 1997. |
| 7) | Edstrom, L. and Larsson, L.: Effects of age on contractile and enzyme-histochemical properties of fast- and slow-twitch single motor units in the rat. J. Physiol., 392, 129-145, 1987. |
| 8) | Einsiedel, L.J. and Luff, A.R.: Alterations in the contractile properties of motor units within the ageing rat medial gastrocnemius. J. Neurol. Sci., 112, 170-177, 1992. |
| 9) | Furuno, K., Goodman, M.N. and Goldberg, A.L.: Role of different proteolytic systems in the degradation of muscle proteins during denervation atrophy. J. Biol. Chem., 265, 8550-8557, 1990. |
| 10) | 後藤勝正: トレーニングと骨格筋筋小胞体。生化学,生理学からみた骨格筋に対するトレーニング効果(第2版),山田 茂,福永哲夫編。ナップ,東京,pp. 56-81, 2003. |
| 11) | 後藤勝正: 細胞膜興奮機構の疲労と老化。分子の目でみた骨格筋の疲労(第1版),吉岡利忠監,山田 茂,後藤勝正編。ナップ,東京,pp. 100-110, 2003. |
| 12) | Goto, K., Okuyama, R., Honda, M., Uchida, H., Akema, T., Ohira, Y. and Yoshioka, T.: Profiles of connectin (titin) in atrophied soleus muscle induced by unloading rats. J. Appl. Physiol., 94, 897-902, 2003. |
| 13) | Goto, K., Okuyama, R., Sugiyama, H., Honda, M., Kobayashi, T., Uehara, K., Akema, T., Sugiura, T., Yamada, S., Ohira, Y. and Yoshioka, T.: Effects of heat stress and mechanical stretch on protein expression in cultured skeletal muscle cells. Pflügers Arch. Eur. J. Physiol., 447, 247-253, 2003. |
| 14) | Goto, K., Honda, M., Kobayashi, T., Uehara, K., Kojima, A., Akema, T., Sugiura, T., Yamada, S., Ohira, Y. and Yoshioka, T.: Heat stress facilitates the recovery of atrophied soleus muscle in rat. Jpn. J. Physiol., 54, 285-293, 2004. |
| 15) | Goto, K., Oda, H., Morioka, S., Naito, T., Akema, T., Kato, H., Fujiya, H., Nakajima, Y., Sugiura, T., Ohira, Y. and Yoshioka, T.: Skeletal muscle hypertrophy induced by low-intensity exercise with heat-stress in healthy human subjects. Jpn. J. Aerospace Environ. Med., 44, 13-18, 2007. |
| 16) | Gutmann, E. and Hanzlikova, V.: Basic mechanisms of aging in the neuromuscular system. Mech. Ageing Dev., 1, 327-349, 1973. |
| 17) | Hawke, T.J. and Garry, D.J.: Myogenic satellite cells: physiology to molecular biology. J. Appl. Physiol., 91, 534-551, 2001. |
| 18) | Hu, M.C., Lee, D.F., Xia, W., Golfman, L.S., Ou-Yang, F., Yang, J.Y., Zou, Y., Bao, S., Hanada, N., Saso, H., Kobayashi, R. and Hung, M.C.: IκB kinase promotes tumorigenesis through inhibition of Forkhead FOXO3a. Cell, 117, 225-237, 2004. |
| 19) | 岩井一宏: ユビキチンシステムとストレス応答。蛋白質 核酸 酵素,43, 759-765, 1999. |
| 20) | Kawano, F.: Role of gravitational loading on skeletal muscle fiber growth in rats. Master's thesis, National Institute of Fitness and Sports, 2002. |
| 21) | Kawano, F., Ishihara, A., Stevens, J.L., Wang, X.D., Ohshima, S., Horisaka, M., Maeda, Y., Nonaka, I. and Ohira, Y.: Tension- and afferent input-associated responses of neuromuscular system of rats to hindlimb unloading and/or tenotomy. Am. J. Physiol. Regul. Integr. Comp. Physiol., 287, R76-R86, 2004. |
| 22) | Kenney, W.L. and Munce, T.A.: Aging and sarcopenia. J. Appl. Physiol., 95, 1717-1727, 2003. |
| 23) | Ku, Z., Yang, J., Menon, V. and Thomason, D.B.: Decreased polysomal HSP-70 may slow polypeptide elongation during skeletal muscle atrophy. Am. J. Physiol. Cell, Physiol., 268, C1369-C1374, 1995. |
| 24) | Mayhew, M., Renganathan, M. and Delbono, O.: Effectiveness of caloric restriction in preventing age-related changes in rat skeletal muscle. Biochem. Biophys. Res. Commun., 251, 95-99, 1998. |
| 25) | Mitch, W.E., Bailey, J.L., Wang, X., Jurkovitz, C., Newby, D. and Price, S.R.: Evaluation of signals activating ubiquitin-proteasome proteoplysis in a model of muscle wasting. Am. J. Physiol., 276, C1132-C1138, 1999. |
| 26) | Narayanan, N., Jones, D.L., Xu, A. and Yu, J.C.: Effects of aging on sarcoplasmic reticulum function and contraction duration in skeletal muscles of the rat. Am. J. Physiol., 271, C1032-C1040, 1996. |
| 27) | 成澤三雄: 加齢(中高年)と筋力の維持。筋力をデザインする(第1版),吉岡利忠,後藤勝正,石井直方編。杏林書院,東京,pp. 81-93, 2003. |
| 28) | Ohira, Y., Yoshinaga, T., Ohara, M., Nonaka, I., Yoshioka, T., Yamashita-Goto, K., Shenkman, B.S., Kozlovskaya, I.B., Roy, R.R. and Edgerton, V.R.: Myonuclear domain and myosin phenotype in human soleus after bed rest with or without loading. J. Appl. Physiol., 87, 1776-1785, 1999. |
| 29) | 大平充宣,石原昭彦,若月 徹: 無重力環境下における筋萎縮と変性,神経研究の進歩,44, 282-291, 2000. |
| 30) | Ohira, Y., Nomura, T., Kawano, F., Sato, Y., Ishihara, A. and Nonaka, I.: Effects of nine weeks of unloading on neuromuscular activities in adult rats. J. Gravit. Physiol., 9, 49-60, 2002. |
| 31) | Renganathan, M., Messi, M.L. and Delbono, O.: Dihydropyridine receptor-ryanodine receptor uncoupling in aged skeletal muscle. J. Membr. Biol., 157, 247-253, 1997. |
| 32) | Sandri, M., Sandri, C., Gilbert, A., Skurh, C., Calabria, E., Picard, A., Walsh, K., Schiaffino, S., Lecker, S.H. and Goldberg, A.L.: Foxo transcription factors induce the atrophy-related ubiquitin ligase atrogin-1 and cause skeletal muscle atrophy. Cell, 117, 399-412, 2004. |
| 33) | Sandri, M., Lin, J., Handschin, C., Yang, W., Arany, Z.P., Lecker, S.H., Goldberg, A.L. and Spiegelman, B.M.: PGC-1alpha protects skeletal muscle from atrophy by suppressing FoxO3 action and atrophy-specific gene transcription. Proc. Natl. Acad. Sci. U S A, 103, 16260-16265, 2006. |
| 34) | 佐藤祐造: 高齢者と運動。高齢者運動処方ガイドライン(第1版),佐藤祐造編。南江堂,東京,pp. 1-6, 2002. |
| 35) | Taillandier, D., Aurousseau, E., Meyial-Denis, D., Bechet, D., Ferrara, M., Cottin, P., Ducastaing, A., Bigard, X., Guezennec, C.-Y., Schimid, H.-P. and Attaix, D.: Coordinate activation of lysosomal, Ca2+-activated and ATP-ubiquitin-dependent proteinase in the unweighted rat soleus muscle. Biochem. J., 316, 65-72, 1996. |
| 36) | Tawa, N.E., Odessey, R. and Goldberg, A.L.: Inhibitors of the proteasome reduce the accelerated proteolysis in atrophying rat skeletal muscles. J. Clin. Invest., 100, 197-203, 1997. |
| 37) | Uehara, K., Goto, K., Kobayashi, T., Kojima, A., Akema, T., Sugiura, T., Yamada, S., Ohira, Y., Yoshioka, T. and Aoki, H.: Heat-stress enhances prolifeartive potential in rat soleus muscle. Jpn. J. Physiol., 54, 263-271, 2004. |
| 38) | Winiarski, A.M., Roy, R.R., Alford, E.K., Chiang, P.C. and Edgerton, V.R.: Mechanical properties of rat skeletal muscle after hind limb suspension. Exp. Neurol., 96, 650-660, 1987. |
| 39) | 山田 茂: 骨格筋萎縮の可逆性。運動と生体諸機能。適応と可逆性,森谷敏夫編。ナップ,東京,pp. 108-122, 1999. |
| 40) | 山下勝正: 不活動が骨格筋の機能に及ぼす影響。骨格筋。運動による機能と形態の変化,山田 茂,福永哲夫編。ナップ,東京,pp. 214-233, 1997. |
| 41) | Yamashita-Goto, K., Okuyama, R., Honda, M., Kawasaki, K., Fujita, K., Yamada, Y., Nonaka, I., Ohira, Y. and Yoshioka, T.: Maximal and submaximal forces of slow fibers in human soleus after bed rest. J. Appl. Physiol., 91, 417-424, 2001. |
| 42) | Yamashita-Goto, K., Ohira, Y., Okuyama, R., Sugiyama, H., Honda, M., Sugiura, T., Yamada, S., Akema, T. and Yoshioka, T.: Heat stress facilitates stretch-induced hypertrophy of cultured muscle cells. J. Gravt. Physiol., 9, 145-146, 2002. |
| 43) | 横沢英良: ユビキチンワールド。蛋白質 核酸 酵素,43, 732-736, 1999. |
| 44) | 吉岡利忠: 骨格筋萎縮のメカニズム。J.J. Sports Sci., 10, 615-620, 1991. |
| 45) | 吉岡利忠,後藤勝正,川崎健介: 筋萎縮のメカニズム,医学のあゆみ,193, 598-603, 2000. |
連絡先: 後藤勝正
〒440-8511
愛知県豊橋市牛川町松下20-1
豊橋創造大学リハビリテーション学部
TEL: 050-2017-2272
FAX: 0532-55-0803
E-mail: goto@sozo.jp